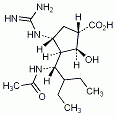
Die Food and Drug Administration (FDA) hat Nivolumab (Opdivo, BMS) beschleunigt als Durchbruch-Therapie für die Behandlung von Patienten mit nicht resektablem oder metastasiertem, refraktären Melanom zugelassen. Es soll bei Patienten eingesetzt werden, die zuvor mit Ipilimumab oder einem BRAF-Hemmer behandelt wurden, wenn deren Tumor BRAF-V600 exprimiert.
Nivolumab ist ein monoklonaler Antikörper, der das PD1-Protein hemmt. PD1 (Programmed Death) ist ein Rezeptor, der auf aktivierten T-Zellen exprimiert wird. Er wird auch als „Key immunocheckpoint“ bezeichnet, weil ihm eine Schlüsselstellung bei Immunreaktionen zukommt. Der PD1-Rezeptor wird durch die PD1-Liganden PD-L1 und PD-L2 aktiviert, die von Tumor- und von Stromazellen gebildet werden. Binden die Liganden an den Rezeptor, wird im Sinne einer Immunsuppression die antitumorale Immunantwort verringert. Bei Blockade des PD1-Rezeptors wird die T-Zell-Aktivität im Bereich des Tumors verstärkt und damit die Immunreaktion gegen die Tumorzellen aktiviert.
Nivolumab war der weltweit erste zugelassene PD1-Hemmer. Er wurde im Juli 2014 in Japan für die Behandlung von Patienten mit nicht resezierbarem Melanom zugelassen. Pembrolizumab hat die FDA Anfang September 2014 für Melanompatienten beschleunigt zugelassen.
Quelle
Pressemitteilung der FDA vom 22. Dezember 2014
Dienstag, 30. Dezember 2014
Peramivir von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Peramivir (Rapivab, BioCryst Pharmaceuticals) für die Behandlung der Influenza bei Erwachsenen zugelassen.
Peramivir ist wie Oseltamivir (Tamiflu) und Zanamivir (Relenza) ein Neuraminidase-Hemmer, der jedoch einmalig intravenös appliziert wird. Er kann bei Patienten ab 18 Jahren mit akuter unkomplizierter Influenza eingesetzt werden, deren Symptome noch nicht länger als zwei Tage anhalten.
Die Wirksamkeit wurde in einer randomisierten Studie mit Influenza-Patienten untersucht, die Plazebo oder 300 mg oder 600 mg Peramivir erhielten. Mit 600 mg Peramivir besserten sich die Influenza-Symptome im Mittel 21 Stunden früher als in der Plazebo-Gruppe. Die Körpertemperatur normalisierte sich im Mittel um 12 Stunden früher. Diese Befunde konnten in weiteren Studie bestätigt werden.
Bei Patienten mit schwerer Influenza, die eine Hospitalisierung erfordert, war Peramivir nicht wirksam.
Häufige Nebenwirkungen waren Durchfall, Selten aber schwerwiegend waren schwere Hautreaktionen wie Stevens-Johnson-Syndrom oder Erythema multiforme. Halluzinationen, Delirium oder ungewöhnliches Verhalten unter der Therapie mit Neuraminidase-Hemmern können durch die Influenza selbst hervorgerufen werden. Unklar ist, inwieweit Neuraminidase-Hemmer als auslösende Faktoren eine Rolle spielen.
Quelle:
Pressemitteilung der FDA vom 22. Dezember 2014
Peramivir ist wie Oseltamivir (Tamiflu) und Zanamivir (Relenza) ein Neuraminidase-Hemmer, der jedoch einmalig intravenös appliziert wird. Er kann bei Patienten ab 18 Jahren mit akuter unkomplizierter Influenza eingesetzt werden, deren Symptome noch nicht länger als zwei Tage anhalten.
Die Wirksamkeit wurde in einer randomisierten Studie mit Influenza-Patienten untersucht, die Plazebo oder 300 mg oder 600 mg Peramivir erhielten. Mit 600 mg Peramivir besserten sich die Influenza-Symptome im Mittel 21 Stunden früher als in der Plazebo-Gruppe. Die Körpertemperatur normalisierte sich im Mittel um 12 Stunden früher. Diese Befunde konnten in weiteren Studie bestätigt werden.
Bei Patienten mit schwerer Influenza, die eine Hospitalisierung erfordert, war Peramivir nicht wirksam.
Häufige Nebenwirkungen waren Durchfall, Selten aber schwerwiegend waren schwere Hautreaktionen wie Stevens-Johnson-Syndrom oder Erythema multiforme. Halluzinationen, Delirium oder ungewöhnliches Verhalten unter der Therapie mit Neuraminidase-Hemmern können durch die Influenza selbst hervorgerufen werden. Unklar ist, inwieweit Neuraminidase-Hemmer als auslösende Faktoren eine Rolle spielen.
Quelle:
Pressemitteilung der FDA vom 22. Dezember 2014
Montag, 29. Dezember 2014
Afamelanotid von der EU-Kommission zugelassen
Die EU-Kommission hat am 24. Dezember 2014 Afamelanotid (Scenesse, Clinuvel) zur Prävention der Phototoxizität bei Erwachsenen mit erythropoetischer Porphyrie (EPP) zugelassen.
Afamelatonid ist ein synthetisches Analogon von alpha-Melanozyten-stimulierendem Hormon, das als Melanocortin-1-Rezeptoragonist wirkt und so die Melanogenese stimuliert. Dies führt zu einer verstärkten Pigmentierung der Haut.
Afamelanotid verringert die Lichtempfindlichkeit, was es den EPP-Patienten ermöglicht, sich länger dem Tages- oder Sonnenlicht auszusetzen. Weil sie sich mehr im Freien aufhalten können, verbessert sich die Lebensqualität. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Nasopharyngitis, Migräne, Bauchschmerzen, Fatigue, Lethargie und Somnolenz. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EU-Kommission
Afamelatonid ist ein synthetisches Analogon von alpha-Melanozyten-stimulierendem Hormon, das als Melanocortin-1-Rezeptoragonist wirkt und so die Melanogenese stimuliert. Dies führt zu einer verstärkten Pigmentierung der Haut.
Afamelanotid verringert die Lichtempfindlichkeit, was es den EPP-Patienten ermöglicht, sich länger dem Tages- oder Sonnenlicht auszusetzen. Weil sie sich mehr im Freien aufhalten können, verbessert sich die Lebensqualität. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Nasopharyngitis, Migräne, Bauchschmerzen, Fatigue, Lethargie und Somnolenz. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EU-Kommission
Dienstag, 23. Dezember 2014
Amtliche ATC-Klassifikation mit DDD für 2015 veröffentlicht
Ab sofort bietet das DIMDI die 12. aktualisierte amtliche Fassung der Anatomisch-Therapeutisch-Chemischen Klassifikation (ATC-Klassifikation) inklusive definierter Tagesdosen (DDD) zum kostenfreien Download an: ATC/DDD-Klassifikation 2015 im Downloadcenter
Sie tritt am 1. Januar 2015 in Kraft.
Grundlage für die amtliche Fassung ist die internationale ATC/DDD-Klassifikation der WHO. Diese wird ebenfalls einmal jährlich aktualisiert. Um dem deutschen Arzneimittelmarkt gerecht zu werden, wird sie jährlich an die Besonderheiten der Versorgungssituation in Deutschland angepasst. Dazu dient ein transparentes, regelgebundenes Verfahren. Das DIMDI gibt die ATC-Klassifikation im Auftrag des Bundesministeriums für Gesundheit heraus.
Die Klassifikation erlaubt es, Tagestherapiekosten von Arzneimitteln anzugeben und zu vergleichen. Das ermöglichen die DDD-Angaben, die einzelnen Wirkstoffen zugeordnet werden. Gesetzliche Grundlage hierfür bildet § 73 Abs. 8 Satz 5 im Fünften Buch Sozialgesetzbuch (SGB V). Die DDD-Angaben beruhen auf der angenommenen mittleren täglichen Erhaltungsdosis für die Hauptindikation eines Wirkstoffes bei Erwachsenen. Sie entsprechen daher nicht zwangsweise der im Einzelfall angewendeten Dosierung eines Arzneimittels. Gleiches gilt für die auf dieser Basis errechneten Tagestherapiekosten.
Quelle:
Pressemitteilung des DIMDI vom 23. Dezember 2014
Sie tritt am 1. Januar 2015 in Kraft.
Grundlage für die amtliche Fassung ist die internationale ATC/DDD-Klassifikation der WHO. Diese wird ebenfalls einmal jährlich aktualisiert. Um dem deutschen Arzneimittelmarkt gerecht zu werden, wird sie jährlich an die Besonderheiten der Versorgungssituation in Deutschland angepasst. Dazu dient ein transparentes, regelgebundenes Verfahren. Das DIMDI gibt die ATC-Klassifikation im Auftrag des Bundesministeriums für Gesundheit heraus.
Die Klassifikation erlaubt es, Tagestherapiekosten von Arzneimitteln anzugeben und zu vergleichen. Das ermöglichen die DDD-Angaben, die einzelnen Wirkstoffen zugeordnet werden. Gesetzliche Grundlage hierfür bildet § 73 Abs. 8 Satz 5 im Fünften Buch Sozialgesetzbuch (SGB V). Die DDD-Angaben beruhen auf der angenommenen mittleren täglichen Erhaltungsdosis für die Hauptindikation eines Wirkstoffes bei Erwachsenen. Sie entsprechen daher nicht zwangsweise der im Einzelfall angewendeten Dosierung eines Arzneimittels. Gleiches gilt für die auf dieser Basis errechneten Tagestherapiekosten.
Quelle:
Pressemitteilung des DIMDI vom 23. Dezember 2014
Sonntag, 21. Dezember 2014
Ceftolozan/Tazobactam von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Ceftolozan/Tazobactam (Zerbaxa, Cubist) zur parenteralen Behandlung von Erwachsenen mit komplizierten intraabdominalen Infektionen in Kombination mit Metronidazol und komplizierten Harnwegsinfektionen als Qualified Infectious Disease Product (QIDP) beschleunigt zugelassen. Damit hat die FDA im Jahr 2014 vier neue Antibiotika zugelassen.
Das Cephalosporin Ceftolozan zeichnet sich durch eine hohe Wirksamkeit gegen gramnegative Bakterien wie Pseudomonas aeruginosa aus. Tazobactam ist ein seit vielen Jahren in der Therapie bewährter Beta-Lactamase-Hemmer, der den Abbau des Beta-Lactam-Antibiotikums Ceftolozan
durch Beta-Lactamasen verhindert.
Die Wirksamkeit und Verträglichkeit bei komplizierten intraabdominalen wurde in Kombination mit Metronidazol im Vergleich zu Meropenem bei 979 Patienten untersucht. Beide Antibiotika erwiesen sich als vergleichbar wirksam.
Wirksamkeit und Verträglichkeit bei komplizierten Harnwegsinfektionen wurden im Vergleich zu Levofloxacin in einer Studie mit 1.068 Patienten belegt.
Ceftolozan wirkt bei Patienten mit Nierenfunktionsstörungen eingeschränkt. Häufigste Nebenwirkungen in den Studien waren Übelkeit, Durchfall, Kopfschmerzen und Fieber.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Das Cephalosporin Ceftolozan zeichnet sich durch eine hohe Wirksamkeit gegen gramnegative Bakterien wie Pseudomonas aeruginosa aus. Tazobactam ist ein seit vielen Jahren in der Therapie bewährter Beta-Lactamase-Hemmer, der den Abbau des Beta-Lactam-Antibiotikums Ceftolozan
durch Beta-Lactamasen verhindert.
Die Wirksamkeit und Verträglichkeit bei komplizierten intraabdominalen wurde in Kombination mit Metronidazol im Vergleich zu Meropenem bei 979 Patienten untersucht. Beide Antibiotika erwiesen sich als vergleichbar wirksam.
Wirksamkeit und Verträglichkeit bei komplizierten Harnwegsinfektionen wurden im Vergleich zu Levofloxacin in einer Studie mit 1.068 Patienten belegt.
Ceftolozan wirkt bei Patienten mit Nierenfunktionsstörungen eingeschränkt. Häufigste Nebenwirkungen in den Studien waren Übelkeit, Durchfall, Kopfschmerzen und Fieber.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Ombitasvir/Paritaprevir/Ritonavir mit Dasabuvir von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Ombitasvir/Paritaprevir/Ritonavir in einer Packung mit Dasabuvir-Tabletten (Viekira Pak, Abbvie) zur Behandlung von Erwachsenen mit chronischer Hepatitis C zugelassen.
Die EMA hat im November 2014 die Zulassung der Dreierkombination empfohlen.
Ombitasvir ist ein Inhibitor des viralen NS5A-Protein, das für die Virusreplikation essenziell ist.
Paritaprevir ist ein Inhibitor der NS3/4A-Protease, die ebenfalls für die Virusreplikation essenziell ist.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Die EMA hat im November 2014 die Zulassung der Dreierkombination empfohlen.
Ombitasvir ist ein Inhibitor des viralen NS5A-Protein, das für die Virusreplikation essenziell ist.
Paritaprevir ist ein Inhibitor der NS3/4A-Protease, die ebenfalls für die Virusreplikation essenziell ist.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Freitag, 19. Dezember 2014
Finafloxacin von der FDA bei Otitis externa zugelassen
Die Food and Drug Administration (FDA) hat Finafloxacin (Xtoro, Alcon) als Ohrentropfen zur Behandlung einer Otitis externa ausgelöst durch Pseudomonas aeruginosa und Staphylococcus aureus zugelassen.
Finafloxacin ist ein Fluorchinolon, dessen Wirksamkeit und Verträglichkeit bei Otitis externa in zwei Studien mit 1234 Patienten untersucht wurden. Bei den 560 Patienten, deren Otitis durch Pseudomonas aeruginosa oder Staphylococcus aureus hervorgerufen worden war, konnte mit Finafloxacin in 70 % der Fälle, mit dem Plazebo in 37 % eine klinische Heilung erreicht werden. Bei Behandlung mit dem Fluorchinolon konnten die Erreger häufiger eliminiert und die Schmerzen rasch beseitigt werden. Häufigste Nebenwirkungen waren Juckreiz im Ohr und Übelkeit.
Quelle:
Pressemitteilung der FDA vom 17. Dezember 2014
Finafloxacin ist ein Fluorchinolon, dessen Wirksamkeit und Verträglichkeit bei Otitis externa in zwei Studien mit 1234 Patienten untersucht wurden. Bei den 560 Patienten, deren Otitis durch Pseudomonas aeruginosa oder Staphylococcus aureus hervorgerufen worden war, konnte mit Finafloxacin in 70 % der Fälle, mit dem Plazebo in 37 % eine klinische Heilung erreicht werden. Bei Behandlung mit dem Fluorchinolon konnten die Erreger häufiger eliminiert und die Schmerzen rasch beseitigt werden. Häufigste Nebenwirkungen waren Juckreiz im Ohr und Übelkeit.
Quelle:
Pressemitteilung der FDA vom 17. Dezember 2014
Lenalidomid, Insulin degludec, Bortezomib, Xiapex: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2014 empfohlen, die Zulassung von vier Substanzen zu erweitern.
Quelle:
Mitteilungen der EMA vom 19. Dezember 2014
- Lenalidomid (Revlimid) soll künftig auch zur kontinuierlichen Therapie von Erwachsenen mit bislang unbehandeltem multiplem Myelom eingesetzt werden, für die eine Transplantation nicht in Frage kommt.
- Bortezomib (Velcade) soll in Kombination mit Rituximab, Cyclophosphamid, Doxorubicin und Prednisone für die Therapie von Erwachsenen mit bisher unbehandeltem Mantel-Zell-Lymphom eingesetzt werden, für die eine hämatopoetische Stammzelltransplantation nicht in Frage kommt.
- Insulin degludec (Tresiba) soll künftig bei Heranwachsenden und Kindern ab einem Jahr zur Behandlung des Diabetes mellitus angewendet werden können.
- Collagenase Clostridium histolyticum (Xiapex) soll künftig zur Behandlung von erwachsenen Männern mit Induratio Penis Plastica eingesetzt werden können.
Quelle:
Mitteilungen der EMA vom 19. Dezember 2014
Dalbavancin von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2014 empfohlen, Dalbavancin (Xydalba, Durata Therapeutics) zur Behandlung von Patienten mit akuten bakteriellen Haut- und Weichgewebeinfektionen zuzulassen.
Das lipopile Glykopeptid (Lipoglykopeptid) Dalbavancin ist ein semisynthetischer Abkömmling von Teicoplanin, der parenteral verabreicht werden muss. Dalbavancin wirkt gegen eine Vielzahl grampositiver Erreger inklusive MRSA und VRSA. Gegen gramnegative Bakterien ist Dalbavancin nahezu inaktiv. Es wird zu 93 % an Plasmaproteine gebunden, was zu seiner extrem langen Halbwertszeit von 150 bis 250 Stunden beiträgt.
Die Zulassung für Dalbavancin war schon einmal von Pfizer beantragt worden, der Zulassungsantrag wurde am im Jahr 2008 zurück gezogen. Inzwischen wurden weitere Studie mit dem Antibiotikum durchgeführt. Bei Patienten mit Haut- und Weichgewebeinfektionen erwies es sich als vergleichbar gut wirksam wie Vancomycin.
Häufigste unerwünschte Wirkungen waren Übelkeit, Kopfschmerzen und Durchfall. Unter Dalbavancin kam es zudem häufiger zu einem Anstieg der Leberenzymparameter als in der Vergleichsgruppe. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Dalbavancin wurde im Mai 2014 von der FDA zugelassen
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
Das lipopile Glykopeptid (Lipoglykopeptid) Dalbavancin ist ein semisynthetischer Abkömmling von Teicoplanin, der parenteral verabreicht werden muss. Dalbavancin wirkt gegen eine Vielzahl grampositiver Erreger inklusive MRSA und VRSA. Gegen gramnegative Bakterien ist Dalbavancin nahezu inaktiv. Es wird zu 93 % an Plasmaproteine gebunden, was zu seiner extrem langen Halbwertszeit von 150 bis 250 Stunden beiträgt.
Die Zulassung für Dalbavancin war schon einmal von Pfizer beantragt worden, der Zulassungsantrag wurde am im Jahr 2008 zurück gezogen. Inzwischen wurden weitere Studie mit dem Antibiotikum durchgeführt. Bei Patienten mit Haut- und Weichgewebeinfektionen erwies es sich als vergleichbar gut wirksam wie Vancomycin.
Häufigste unerwünschte Wirkungen waren Übelkeit, Kopfschmerzen und Durchfall. Unter Dalbavancin kam es zudem häufiger zu einem Anstieg der Leberenzymparameter als in der Vergleichsgruppe. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Dalbavancin wurde im Mai 2014 von der FDA zugelassen
Mitteilung der EMA vom 19. Dezember 2014
Safinamid von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in
seiner Sitzung vom Dezember 2014 empfohlen, Safinamid (Xadago, Zambon) für die Behandlung von erwachsenen Patienten mit idiopathischer Parkinson-Krankheit als Add-on-Therapie zu Levodopa oder in Kombination mit anderen Parkinsonmitteln zuzulassen, mit Fluktuationen im mittleren oder späten Stadium.
Safinamid ist ein hochselektiver und reversibler Hemmer der Monoaminooxidase B (MAO B), der zu einem Anstieg der extrazellulären Dopamin-Konzentration im Striatum führt. Es hemmt darüber hinaus spannungsabhängige Natriumkanäle und moduliert die stimulierte Freisetzung von Glutamat.
Vorteil ist die Verbesserung der On-Zeit bei Patienten mit motorischen Fluktuationen unter alleiniger oder kombinierter Levodopa-Therapie.
Häufigste Nebenwirkungen sind Dyskinesie, Somnolenz, Benommenheit, Kopfschmerzen, Schlafstörungen, Übelkeit und orthostatische Hypotonie.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
seiner Sitzung vom Dezember 2014 empfohlen, Safinamid (Xadago, Zambon) für die Behandlung von erwachsenen Patienten mit idiopathischer Parkinson-Krankheit als Add-on-Therapie zu Levodopa oder in Kombination mit anderen Parkinsonmitteln zuzulassen, mit Fluktuationen im mittleren oder späten Stadium.
Safinamid ist ein hochselektiver und reversibler Hemmer der Monoaminooxidase B (MAO B), der zu einem Anstieg der extrazellulären Dopamin-Konzentration im Striatum führt. Es hemmt darüber hinaus spannungsabhängige Natriumkanäle und moduliert die stimulierte Freisetzung von Glutamat.
Vorteil ist die Verbesserung der On-Zeit bei Patienten mit motorischen Fluktuationen unter alleiniger oder kombinierter Levodopa-Therapie.
Häufigste Nebenwirkungen sind Dyskinesie, Somnolenz, Benommenheit, Kopfschmerzen, Schlafstörungen, Übelkeit und orthostatische Hypotonie.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
Naltrexon/Bupropion: Zulassungserweiterung von der EMA empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2014 empfohlen, Naltrexon/Bupropion (Mysimba, Orexigen Therapeutics) für das Gewichtsmanagement übergewichtiger Erwachsener zusätzlich zu kalorienreduzierter Ernährung und körperlicher Aktivität zuzulassen. Es soll für Adipöse mit einem Body-Mass-Index von 30 kg/qm oder mehr sowie für Übergewichtige mit einem BMI ab 27 kg/qm und einem weiteren Gewichts-abhängigen Risikofaktor wie Bluthochdruck, Typ-2-Diabetes oder hohem Cholesterol-Werte zugelassen werden.Naltrexon wird bereits zur Behandlung von Alkohol- und Opioid-Sucht angewendet, Bupropion wird gegen Depressionen und zum Nicotin-Entzug eingesetzt Die Kombination wird als Tablette mit verlängerter Wirkstofffreisetzung angeboten.
Die Wirksamkeit wurde in vier klinischen Studien mit übergewichtigen Patienten untersucht. Die häufigsten Nebenwirkungen in den klinischen Studien waren Übelkeit, Erbrechen, Durchfall, Verstopfung, Kopfschmerzen, Benommenheit, Schlaflosigkeit und trockener Mund.
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
Die Wirksamkeit wurde in vier klinischen Studien mit übergewichtigen Patienten untersucht. Die häufigsten Nebenwirkungen in den klinischen Studien waren Übelkeit, Erbrechen, Durchfall, Verstopfung, Kopfschmerzen, Benommenheit, Schlaflosigkeit und trockener Mund.
Mitteilung der EMA vom 19. Dezember 2014
Erste Stammzelltherapie zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat
in seiner Sitzung vom Dezember 2014 erstmals empfohlen, eine Stammzelltherapie (Holoclar, Chiesi) für die Behandlung einer mäßig schweren bis schweren Defizienz an limbalen Stammzellen aufgrund einer physischen oder chemischen Verbrennung am Auge bei Erwachsenen bedingt zuzulassen.
Limbale Stammzellen sind im Auge an der Grenze zwischen Cornea und Sklera lokalisiert. Sie sind für die Regeneration und Heilung von Schäden der äußeren Hornhautschicht wichtig. Verbrennungen am Auge können zu einem Verlust dieser Stammzellen führen, was etwa 3,3/100.000 Menschen in der EU betrifft. Symptome können Schmerzen, Photophobie, Entzündung, Gefläßneubildung in der Hornhaut, Verlust der Transparenz der Hornhaut und Blindheit sein.
Holoclar wird nach Entfernung der verletzten Hornhaut in das Auge implantiert. Es wird aus einer Biopsie hergestellt, die dem Patienten aus einem unbeschädigten Bereich des Auges entnommen wurde und aus der die Zellen in einer Kultur angezüchtet werden.
Holoclar bietet eine Alternative zur Transplantation.
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
in seiner Sitzung vom Dezember 2014 erstmals empfohlen, eine Stammzelltherapie (Holoclar, Chiesi) für die Behandlung einer mäßig schweren bis schweren Defizienz an limbalen Stammzellen aufgrund einer physischen oder chemischen Verbrennung am Auge bei Erwachsenen bedingt zuzulassen.
Limbale Stammzellen sind im Auge an der Grenze zwischen Cornea und Sklera lokalisiert. Sie sind für die Regeneration und Heilung von Schäden der äußeren Hornhautschicht wichtig. Verbrennungen am Auge können zu einem Verlust dieser Stammzellen führen, was etwa 3,3/100.000 Menschen in der EU betrifft. Symptome können Schmerzen, Photophobie, Entzündung, Gefläßneubildung in der Hornhaut, Verlust der Transparenz der Hornhaut und Blindheit sein.
Holoclar wird nach Entfernung der verletzten Hornhaut in das Auge implantiert. Es wird aus einer Biopsie hergestellt, die dem Patienten aus einem unbeschädigten Bereich des Auges entnommen wurde und aus der die Zellen in einer Kultur angezüchtet werden.
Holoclar bietet eine Alternative zur Transplantation.
Quelle:
Mitteilung der EMA vom 19. Dezember 2014
Olaparib von der EU-Kommission und der FDA zugelassen
Die EU-Kommission und die FDA haben im Dezember 2014 Olaparib (Lynparza, AstraZeneca) für die Erhaltungstherapie erwachsener Patientinnen zugelassen, die unter einem Platin-sensitivem Rezidiv (PSR) eines BRCA-mutierten (Keimbahn und/oder somatisch), high grade serösen, epithelialen Ovarial-, Eileiter oder primären Peritonealkarzinoms leiden und auf eine Platin-basierte Chemotherapie vollständig oder teilweise ansprechen.
Olaparib ist ein Hemmer von PARP-1, PARP-2 und PARP-3. Die zelluläre DNS ist ständig schädigenden Einflüssen ausgesetzt, deren Auswirkungen durch Reparaturenzyme wieder beseitigt werden können. An der homologen Rekombination sind Tumorsuppressorproteine wie BRCA1 und BRCA2 beteiligt. Zu den Reparaturenzymen gehört ferner die große Familie der Poly-(ADP-ribose)-Ppolymerasen (PARPs), von denen PARP-1 das wichtigste Enzym ist. Es ist an der Reparatur von Einzelstrangbrüchen der DNS beteiligt. Die verschiedenen Reparaturmechanismen können sich gegenseitig ersetzen, fällt ein Mechanismus aus, können DNS-Schäden normalerweise durch weitere Mechanismen wieder repariert werden. So funktioniert beispielsweise bei Zellen mit mutierten BRCA1- oder -2-Genen der Reparaturmechanismus nicht mehr. Wird PARP bei solchen Zellen gehemmt, sterben die Zellen ab. Dieses Vorgehen wird auch als synthetische Letalität bezeichnet.
Olaparib verbesserte in einer Phase-II-Studie das PFS bei Frauen mit Platin-empfindlichen, rezidivierten hochgradig serösen Ovarial-, Eileiter- und Peritonealkarzinomen mit BRCA-Mutationen im Vergleich zu Plazebo von 4,3 auf 11,2 Monate. .
Häufigste Nebenwirkungen waren Übelkeit, Erbrechen, Durchfall, Dyspepsie, Fatigue, Kopfschmerzen, Dysgeusie, verminderter Appetit, Benommenheit, Anämie, Neutropenie und Lymphopenie. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Olaparib ist ein Hemmer von PARP-1, PARP-2 und PARP-3. Die zelluläre DNS ist ständig schädigenden Einflüssen ausgesetzt, deren Auswirkungen durch Reparaturenzyme wieder beseitigt werden können. An der homologen Rekombination sind Tumorsuppressorproteine wie BRCA1 und BRCA2 beteiligt. Zu den Reparaturenzymen gehört ferner die große Familie der Poly-(ADP-ribose)-Ppolymerasen (PARPs), von denen PARP-1 das wichtigste Enzym ist. Es ist an der Reparatur von Einzelstrangbrüchen der DNS beteiligt. Die verschiedenen Reparaturmechanismen können sich gegenseitig ersetzen, fällt ein Mechanismus aus, können DNS-Schäden normalerweise durch weitere Mechanismen wieder repariert werden. So funktioniert beispielsweise bei Zellen mit mutierten BRCA1- oder -2-Genen der Reparaturmechanismus nicht mehr. Wird PARP bei solchen Zellen gehemmt, sterben die Zellen ab. Dieses Vorgehen wird auch als synthetische Letalität bezeichnet.
Olaparib verbesserte in einer Phase-II-Studie das PFS bei Frauen mit Platin-empfindlichen, rezidivierten hochgradig serösen Ovarial-, Eileiter- und Peritonealkarzinomen mit BRCA-Mutationen im Vergleich zu Plazebo von 4,3 auf 11,2 Monate. .
Häufigste Nebenwirkungen waren Übelkeit, Erbrechen, Durchfall, Dyspepsie, Fatigue, Kopfschmerzen, Dysgeusie, verminderter Appetit, Benommenheit, Anämie, Neutropenie und Lymphopenie. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Pressemitteilung der FDA vom 19. Dezember 2014
Mittwoch, 17. Dezember 2014
Mycophenolatmofetil: Rote-Hand-Brief zu neuen Warnhinweisen
Der Hersteller von Mycophenolatmofetil (CellCept) informiert in einem Rote-Hand-Brief zu neuen Warnhinweisen.
Die Auswertung von Fallberichten und veröffentlichten Studien ergab, dass Mycophenolatmofetil in Kombination mit anderen Immunsuppressiva Hypogammaglobulinämie und Bronchiektasien verursachen kann. Da MPA der aktive Wirkstoff von Mycophenolatmofetil ist, betreffen diese Risiken alle Produkte, die MPA als Wirkstoff freisetzen.
Zusammenfassung der Sicherheitshinweise und Empfehlungen:
Hypogammaglobulinämie:
Bronchiektasien:
Die Produktinformationen werden aktualisiert.
Quelle:
Akd' Drug Safety Mail vom 16. Dezember 2014
Die Auswertung von Fallberichten und veröffentlichten Studien ergab, dass Mycophenolatmofetil in Kombination mit anderen Immunsuppressiva Hypogammaglobulinämie und Bronchiektasien verursachen kann. Da MPA der aktive Wirkstoff von Mycophenolatmofetil ist, betreffen diese Risiken alle Produkte, die MPA als Wirkstoff freisetzen.
Zusammenfassung der Sicherheitshinweise und Empfehlungen:
Hypogammaglobulinämie:
- Bei Patienten, die Mycophenolatmofetil in Kombination mit anderen Immunsuppressiva erhielten, ist über Hypogammaglobulinämie in Verbindung mit rezidivierenden Infektionen berichtet worden.
- Bei Patienten mit rezidivierenden Infektionen sollten die Serum-Immunglobuline gemessen werden.
- In Fällen von anhaltender, klinisch relevanter Hypogammaglobulinämie sollten geeignete klinische Maßnahmen in Betracht gezogen werden. In einigen der berichteten Fälle führte die Umstellung von Mycophenolatmofetil auf ein alternatives Immunsuppressivum zu einer Normalisierung der Serum-IgG-Werte.
Bronchiektasien:
- Bei Patienten, die Mycophenolatmofetil in Kombination mit anderen Immunsuppressiva erhielten, sind Fälle von Bronchiektasien berichtet worden.
- Patienten, die anhaltende pulmonale Symptome wie Husten oder Dyspnoe entwickeln, sollten umgehend ärztlich untersucht werden.
- Der Beginn der Atemwegsbeschwerden variierte von einigen Monaten bis zu mehreren Jahren nach Behandlungsbeginn mit Mycophenolatmofetil.
- In einigen der bestätigten Fälle von Bronchiektasie führte die Umstellung von Mycophenolatmofetil auf ein anderes Immunsuppressivum zu einer Verbesserung der Atemwegsbeschwerden.
- Zusätzlich zur Bronchiektasie wurde über Einzelfälle von interstitieller Lungenerkrankung berichtet, von denen einige einen tödlichen Ausgang hatten.
Die Produktinformationen werden aktualisiert.
Quelle:
Akd' Drug Safety Mail vom 16. Dezember 2014
Montag, 15. Dezember 2014
Pasireotid: EU-Kommission erweitert Zulassung
Die EU-Kommission hat die Zulassung von Pasireotid (Signifor, Novartis) erweitert, es kann nun zur Behandlung von erwachsenen Patienten mit Akromegalie eingesetzt werden, für die ein chirurgischer Eingriff keine Option ist oder nicht kurativ erfolgreich war, und die unter der Behandlung mit einem anderen Somatostatin-Analogon unzureichend kontrolliert sind.
Die aktuelle Zulassung basiert auf den Ergebnissen der zwei multizentrischen, randomisierten Studien C2305 und C2402, in denen Wirksamkeit und Sicherheit von Pasireotid bei erwachsenen Patienten mit unzureichend kontrollierter Akromegalie untersucht wurden. Beide Studien zeigten, dass Pasireotid im Vergleich zu Somatostatin-Analoga der ersten Generation eine bessere biochemische Kontrolle erzielt und das Tumorvolumen reduziert. Dabei war das Nebenwirkungsprofil mit Ausnahme einer höheren Rate an Hyperglykämien und Diabetes mellitus vergleichbar.
Die aktuelle Zulassung basiert auf den Ergebnissen der zwei multizentrischen, randomisierten Studien C2305 und C2402, in denen Wirksamkeit und Sicherheit von Pasireotid bei erwachsenen Patienten mit unzureichend kontrollierter Akromegalie untersucht wurden. Beide Studien zeigten, dass Pasireotid im Vergleich zu Somatostatin-Analoga der ersten Generation eine bessere biochemische Kontrolle erzielt und das Tumorvolumen reduziert. Dabei war das Nebenwirkungsprofil mit Ausnahme einer höheren Rate an Hyperglykämien und Diabetes mellitus vergleichbar.
Samstag, 13. Dezember 2014
Ramucirumab: FDA erweitert Zulassung
Die Food and Drug Administration (FDA) hat die Zulassung von Ramucirumab (Cyramza, Lilly) erweitert, es kann nun auch in Kombination mit Docetaxel für die Behandlung von Patienten mit metastasiertem nichtkleinzelligem Lungenkarzinom (NSCLC) eingesetzt werden. Die Zulasssungserweiterung basiert auch einer klinischen Studie mit 1.253 Patienten mit vorbehandeltem und aggressivem Lungenkarzinom. Sie wurden randomisiert mit Docetaxel ± Ramucirumab bis zur Progression oder Unverträglichkeit der Therapie behandelt. Die Patienten der Ramucirumab-Gruppen überlebten im Mittel 10,5 Monate, die der Vergleichsgruppe um 9.1 Monate.
Häufigste unerwünschte Wirkungen waren Neutropenie, Fatigue und Stomatitis, Blutungen, Thrombosen, Blutdruckerhöhung und verzögerte Wundheilung.
Quelle:
Presseinformation der FDA vom 12. Dezember 2014
Häufigste unerwünschte Wirkungen waren Neutropenie, Fatigue und Stomatitis, Blutungen, Thrombosen, Blutdruckerhöhung und verzögerte Wundheilung.
Quelle:
Presseinformation der FDA vom 12. Dezember 2014
Mittwoch, 10. Dezember 2014
Ivabradin: Rote-Hand-Brief wegen kardiovaskulären Nebenwirkungen
Der Hersteller von Ivabradin (Procoralan) informiert in einem Rote-Hand-Brief über Ergebnisse der SIGNIFY-Studie: Ivabradin hatte keinen positiven Effekt auf den primären zusammengesetzten Endpunkt aus kardiovaskulärem Tod und nicht-tödlichem Myokardinfarkt. In einer vorab festgelegten Patienten-Subgruppe mit symptomatischer Angina pectoris mit CCS-Grad 2 oder höher (geringe Einschränkung bei normalen Tätigkeiten) wurde ein gering, jedoch statistisch signifikant erhöhtes Risiko für den kombinierten Endpunkt beobachtet. Darüber hatte der Hersteller nach einer vorläufigen Auswertung der Daten im Juni 2014 informiert. Der Hersteller berichtet im aktuellen Rote-Hand-Brief weiter, dass die Inzidenz von Bradykardien (symptomatisch und asymptomatisch) in der SIGNIFY-Studie signifikant höher war als unter Placebo. In einer zusammenfassenden Analyse aller doppelblinden, kontrollierten klinischen Studien der Phasen II und III zeigte sich eine signifikant erhöhte Inzidenz von Vorhofflimmern unter Ivabradin im Vergleich zu Placebo.
Im aktuellen Rote-Hand-Brief gibt der Hersteller neue Empfehlungen zur Anwendung von Ivabradin:
Im aktuellen Rote-Hand-Brief gibt der Hersteller neue Empfehlungen zur Anwendung von Ivabradin:
- Bei der symptomatischen Behandlung von Patienten mit chronischer stabiler Angina pectoris sollte eine Ivabradinbehandlung nur begonnen werden, wenn die Ruheherzfrequenz des Patienten größer oder gleich 70 Schläge pro Minute ist.
- Ivabradin sollte abgesetzt werden, wenn die Symptome der Angina pectoris sich nicht innerhalb von drei Monaten verbessern.
- Die gleichzeitige Anwendung von Ivabradin mit Verapamil oder Diltiazem ist nun kontraindiziert.
- Vor Behandlungsbeginn oder wenn eine Dosistitration erwogen wird, sollte die Herzfrequenz öfter anhand von wiederholten Messungen, EKG oder einer ambulanten 24-Stunden-Überwachung kontrolliert werden.
- Das Risiko, Vorhofflimmern zu entwickeln, ist bei Patienten, die mit Ivabradin behandelt werden, erhöht. Eine regelmäßige klinische Überwachung bezüglich des Auftretens von Vorhofflimmern wird empfohlen. Patienten sollten über Anzeichen und Symptome von Vorhofflimmern informiert werden und darauf hingewiesen werden, ihren Arzt aufzusuchen, wenn diese auftreten. Falls während der Behandlung Vorhofflimmern auftritt, sollte das Nutzen-Risiko-Verhältnis einer fortgesetzten Therapie mit Ivabradin sorgfältig überdacht werden.
Quelle:
Naloxegol von der EU-Kommission zugelassen
Die EU-Kommission hat Naloxegol (Moventig, AstraZeneca) für die Behandlung von erwachsenen Patienten mit Opioid-induzierte Obstipation zugelassen, die nicht ausreichend auf Laxanzien ansprechen.
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Naloxegol im September 2014 zugelassen.
Quelle:
Pharmatimes vom 9. Dezember 2014
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Naloxegol im September 2014 zugelassen.
Quelle:
Pharmatimes vom 9. Dezember 2014
Mangelhafte Arzneimittelstudien aus Indien: Liste der betroffenen Arzneimittel
Das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) hat am 9. Dezember 2014 eine Liste mit Arzneimitteln veröffentlicht, bei denen wegen invalider Studiendaten ein Ruhen der Zulassung angeordnet wurde. Betroffen sind insgesamt 80 Arzneimittelzulassungen von 16 pharmazeutischen Unternehmen, für die von der indischen Firma GVK Biosciences Bioäquivalenzstudien durchgeführt wurden.
Hintergrund des Verfahrens war eine Inspektion der französischen Arzneimittelbehörde bei der Firma GVK Biosciences, bei der erhebliche Mängel bei der Studiendurchführung und der Datenvalidität festgestellt worden waren. Wegen der Schwere und der Systematik dieser Mängel können diese Bioäquivalenzstudien nach Ansicht des BfArM nicht weiter als Zulassungsgrundlage akzeptiert werden.
Die betroffenen Arzneimittel sind nicht mehr verkehrsfähig und dürfen nicht mehr von pharmazeutischen Unternehmen, Großhändlern, Apotheken oder anderen Stellen abgegeben bzw. verkauft werden. Patienten, die im Besitz dieser Arzneimittel sind, sollten sich bei Fragen zur weiteren Anwendung an ihren Arzt oder Apotheker wenden.
Derzeit liegen dem BfArM keine Hinweise auf Gesundheitsgefahren für Patienten vor. Bei den betroffenen Arzneimitteln handelt es sich ausschließlich um Generika. Nach Einschätzung des BfArM ist nicht mit Lieferengpässen zu rechnen, weil vergleichbare andere Arzneimittel zur Verfügung stehen.
Quelle:
AkdÄ Drug Safety Mail vom 10. Dezember 2014
Hintergrund des Verfahrens war eine Inspektion der französischen Arzneimittelbehörde bei der Firma GVK Biosciences, bei der erhebliche Mängel bei der Studiendurchführung und der Datenvalidität festgestellt worden waren. Wegen der Schwere und der Systematik dieser Mängel können diese Bioäquivalenzstudien nach Ansicht des BfArM nicht weiter als Zulassungsgrundlage akzeptiert werden.
Die betroffenen Arzneimittel sind nicht mehr verkehrsfähig und dürfen nicht mehr von pharmazeutischen Unternehmen, Großhändlern, Apotheken oder anderen Stellen abgegeben bzw. verkauft werden. Patienten, die im Besitz dieser Arzneimittel sind, sollten sich bei Fragen zur weiteren Anwendung an ihren Arzt oder Apotheker wenden.
Derzeit liegen dem BfArM keine Hinweise auf Gesundheitsgefahren für Patienten vor. Bei den betroffenen Arzneimitteln handelt es sich ausschließlich um Generika. Nach Einschätzung des BfArM ist nicht mit Lieferengpässen zu rechnen, weil vergleichbare andere Arzneimittel zur Verfügung stehen.
Quelle:
AkdÄ Drug Safety Mail vom 10. Dezember 2014
Freitag, 5. Dezember 2014
Dimethylfumarat: Rote-Hand-Brief wegen PML
Bei einer Patientin mit schwerer und lang anhaltender Lymphopenie trat eine progressive multifokale Leukenzephalopathie (PML) auf.
Der Hersteller informiert in einem Rote-Hand-Brief über einen tödlich verlaufenden Fall einer progressiven multifokalen Leukenzephalopathie im Rahmen einer schweren und lang anhaltenden Lymphopenie bei einer Patientin, die über 4,5 Jahre mit Dimethylfumarat (Tecfidera®) behandelt worden ist (siehe auch med|pharm|text-Blog).
Lymphopenie ist eine bekannte unerwünschte Arzneimittelwirkung von Tecfidera®. Der Hersteller empfiehlt, die Patienten über das Risiko einer PML zu informieren. Ein großes Blutbild, einschließlich der Lymphozytenzahl, soll regelmäßig und wenn klinisch indiziert, in engen Zeitabständen bestimmt werden. Bei bestehender Lymphopenie sollte sorgfältig und häufig auf Anzeichen und Symptome neurologischer Funktionsstörungen hin überwacht werden. Wird eine PML vermutet, sollte die Behandlung sofort beendet werden.
Quelle:
AkDÄ Drug Safety Mail vom 4. Dezember 2014
Der Hersteller informiert in einem Rote-Hand-Brief über einen tödlich verlaufenden Fall einer progressiven multifokalen Leukenzephalopathie im Rahmen einer schweren und lang anhaltenden Lymphopenie bei einer Patientin, die über 4,5 Jahre mit Dimethylfumarat (Tecfidera®) behandelt worden ist (siehe auch med|pharm|text-Blog).
Lymphopenie ist eine bekannte unerwünschte Arzneimittelwirkung von Tecfidera®. Der Hersteller empfiehlt, die Patienten über das Risiko einer PML zu informieren. Ein großes Blutbild, einschließlich der Lymphozytenzahl, soll regelmäßig und wenn klinisch indiziert, in engen Zeitabständen bestimmt werden. Bei bestehender Lymphopenie sollte sorgfältig und häufig auf Anzeichen und Symptome neurologischer Funktionsstörungen hin überwacht werden. Wird eine PML vermutet, sollte die Behandlung sofort beendet werden.
Quelle:
AkDÄ Drug Safety Mail vom 4. Dezember 2014
Donnerstag, 4. Dezember 2014
Bromocriptin-haltige Arzneimittel: Rote-Hand-Brief zur Anwendungseinschränkung bei Lactationshemmung
Die Hersteller von Bromocriptin-haltigen Arzneimitteln informieren in einem Rote-Hand-Brief über eine aktuelle Bewertung von niedrig dosiertem Bromocriptin zur Unterdrückung der Milchbildung, die vom Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittel-Agentur (EMA) durchgeführt wurde. Andere Indikationen für Bromocriptin wurden in dieser Bewertung nicht berücksichtigt. Hintergrund waren Bedenken bezüglich seltener, aber potenziell schwerwiegender oder sogar tödlicher Nebenwirkungen, besonders kardiovaskulärer (wie Herzinfarkt und Schlaganfall), neurologischer (wie Krampfanfälle) und psychiatrischer Nebenwirkungen (wie Depressionen und Psychosen).
Die Gesamtzahl der berichteten schwerwiegenden Nebenwirkungen war im Verhältnis zur Exposition insgesamt niedrig, ein kausaler Zusammenhang mit Bromocriptin konnte jedoch nicht ausgeschlossen werden. Im Ergebnis der Bewertung ist daher die Anwendung von Bromocriptin zur Hemmung der Milchbildung auf medizinisch begründete Fälle zu beschränken, die maximale Einzeldosis beträgt 2,5 mg. Bromocriptin wird nicht mehr empfohlen als routinemäßige Gabe zur Hemmung der Milchbildung bzw. zur Linderung von Symptomen nachgeburtlicher Brustschmerzen und anderer damit verbundener Beschwerden. Details zu Kontraindikationen und Warnhinweise sind dem Rote-Hand-Brief zu entnehmen, die Produktinformation wird aktualisiert.
Quelle
AkdÄ Drug Safety Mail vom 3. Dezember 2014
Die Gesamtzahl der berichteten schwerwiegenden Nebenwirkungen war im Verhältnis zur Exposition insgesamt niedrig, ein kausaler Zusammenhang mit Bromocriptin konnte jedoch nicht ausgeschlossen werden. Im Ergebnis der Bewertung ist daher die Anwendung von Bromocriptin zur Hemmung der Milchbildung auf medizinisch begründete Fälle zu beschränken, die maximale Einzeldosis beträgt 2,5 mg. Bromocriptin wird nicht mehr empfohlen als routinemäßige Gabe zur Hemmung der Milchbildung bzw. zur Linderung von Symptomen nachgeburtlicher Brustschmerzen und anderer damit verbundener Beschwerden. Details zu Kontraindikationen und Warnhinweise sind dem Rote-Hand-Brief zu entnehmen, die Produktinformation wird aktualisiert.
Quelle
AkdÄ Drug Safety Mail vom 3. Dezember 2014
Blinatumomab von der FDA beschleunigt zugelassen
Die FDA hat Blinatumomab (Blincyto, Amgen) beschleunigt für die Behandlung von Patienten mit Philadelphia-Chromosom-negativer rezidivierter oder refraktärer akuter B-Vorläufer lymphoblastischer Leukämie (r/rALL) zugelassen.
Blinatumomab ist ein bispezifische T-Zell-aktivierender (BITE®) Antikörper. Diese modifizierten Antikörper wurden so entwickelt, dass sie als Brücke zwischen Krebszellen und T-Zellen fungieren. T-Zellen gehören zu den weißen Blutzellen und können andere Zellen, die der Körper als Bedrohung erkennt, abtöten. Über die vom BITE-Antikörper gebildete Brücke kann die T-Zelle direkt Proteine und Enzyme in die Krebszelle einschleusen, die dort einen programmierten Zelltod auslösen.
Blinatumomab ist ein BiTE®-Antikörper, der zwischen körpereigenen zytotoxischen T-Zellen und CD19-exprimierenden Zellen eine Brücke bildet. CD19 ist ein Oberflächenprotein, das vermehrt von B-Zellen bei B-Zell-Leukämien und -Lymphomen gebildet wird.
Die Zulassung basierte auf dem Ergebnis der Studie MT102-211 mit 185 Patienten, in der mit Blinatumomab 32 % eine komplette Remission mit einer medianen Dauer von 6,7 Monaten erreichten.
Häufigste Nebenwirkungen waren Fieber, Kopfschmerzen, periphere Ödeme, febrile Neutropenie, Übelkeit, Hypokaliämie, Hautausschlag, Tremor und Verstopfung. Neurotoxische Nebenwirkungen traten bei etwa 50 % der Patienten auf und waren ein häufiger Therapieabbruchgrund.
Bei 11 % der Patienten kam es zu einem Zytokin-Freisetzungs-Syndrom, das zum Teil lebensbedrohlich war oder zum Tod führte.
Die Zulassung erfolgt mit einer Risk Evaluation and Mitigation Strategy (REMS).
Quelle:
Mitteilung der FDA vom 3. Dezember 2014
Blinatumomab ist ein bispezifische T-Zell-aktivierender (BITE®) Antikörper. Diese modifizierten Antikörper wurden so entwickelt, dass sie als Brücke zwischen Krebszellen und T-Zellen fungieren. T-Zellen gehören zu den weißen Blutzellen und können andere Zellen, die der Körper als Bedrohung erkennt, abtöten. Über die vom BITE-Antikörper gebildete Brücke kann die T-Zelle direkt Proteine und Enzyme in die Krebszelle einschleusen, die dort einen programmierten Zelltod auslösen.
Blinatumomab ist ein BiTE®-Antikörper, der zwischen körpereigenen zytotoxischen T-Zellen und CD19-exprimierenden Zellen eine Brücke bildet. CD19 ist ein Oberflächenprotein, das vermehrt von B-Zellen bei B-Zell-Leukämien und -Lymphomen gebildet wird.
Die Zulassung basierte auf dem Ergebnis der Studie MT102-211 mit 185 Patienten, in der mit Blinatumomab 32 % eine komplette Remission mit einer medianen Dauer von 6,7 Monaten erreichten.
Häufigste Nebenwirkungen waren Fieber, Kopfschmerzen, periphere Ödeme, febrile Neutropenie, Übelkeit, Hypokaliämie, Hautausschlag, Tremor und Verstopfung. Neurotoxische Nebenwirkungen traten bei etwa 50 % der Patienten auf und waren ein häufiger Therapieabbruchgrund.
Bei 11 % der Patienten kam es zu einem Zytokin-Freisetzungs-Syndrom, das zum Teil lebensbedrohlich war oder zum Tod führte.
Die Zulassung erfolgt mit einer Risk Evaluation and Mitigation Strategy (REMS).
Quelle:
Mitteilung der FDA vom 3. Dezember 2014
Donnerstag, 27. November 2014
Dulaglutid von der EU-Kommission zugelassen
Die EU-Kommission hat am 25. November 2014 Dulaglutid (Trulicity, Lilly) für die Behandlung von Patienten mit Diabetes mellitus Typ 2 zugelassen. Dulaglutid kann in Monotherapie bei Patienten angewendet werden, die auf Diät und körperliche Aktivität nicht ausreichend ansprechen und bei denen Metformin nicht eingesetzt werden kann. Außerdem ist die Anwendung in Kombination mit anderen Blutzuckerspiegel-senkenden Medikamenten einschließlich Insulin möglich.
Dulaglutid ist wie Exenatid, Liraglutid und Lixisenatid ein s.c. applizierbarer GLP1-Rezeptoragonist.
Quelle:
Mitteilung der EU-Kommission
Dulaglutid ist wie Exenatid, Liraglutid und Lixisenatid ein s.c. applizierbarer GLP1-Rezeptoragonist.
Quelle:
Mitteilung der EU-Kommission
Darunavir: EU-Kommission erweitert Zulassung
Die EU-Kommission hat am 21. November 2014 die Zulassung von Darunavir (Prezista, Janssen-Cilag) so erweitert, dass es zusammen mit Cobicistat als Rezolsta in Kombination mit anderen antiretroviralen Medikamenten für die Behandlung der HIV-Infektion bei Erwachsenen eingesetzt werden kann.
Quelle:
Mitteilung der EU-Kommission
Quelle:
Mitteilung der EU-Kommission
Nintedanib von der EU-Kommission bei NSCLC zugelassen
Die EU-Kommission hat am 25. November 2014 Nintedanib (Vargatef, Boehringer Ingelheim) in Kombination mit Docetaxel für die Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht kleinzelligen Bronchialkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinientherapie zugelassen.
Nintedanib ist ein Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Die Kombination aus Nintedanib und Docetaxel verlängerte bei Patienten mit NSCLC das PFS und das OS im Vergleich zu Docetaxel. Häufigste Nebenwirkungen sind Neutropenie, verminderter Appetit, Elektrolytstörungen, periphere Neuropathie, Blutungen, Durchfall, Erbrechen, Übelkeit, erhöhte Alaninaminotransferase- und Aspartataminotransferaseaktivität, Mukositis, Hautausschlag.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden
Quelle:
Mitteilung der EU-Kommission
Nintedanib ist ein Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Die Kombination aus Nintedanib und Docetaxel verlängerte bei Patienten mit NSCLC das PFS und das OS im Vergleich zu Docetaxel. Häufigste Nebenwirkungen sind Neutropenie, verminderter Appetit, Elektrolytstörungen, periphere Neuropathie, Blutungen, Durchfall, Erbrechen, Übelkeit, erhöhte Alaninaminotransferase- und Aspartataminotransferaseaktivität, Mukositis, Hautausschlag.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden
Quelle:
Mitteilung der EU-Kommission
Montag, 24. November 2014
Ombitasvir/Paritaprevir/Ritonavir von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Ombitasvir/Paritaprevir/Ritonavir (Viekirax, Abbvir) in Kombination mit anderen Arzneimittel für die Behandlung von Erwachsenen mit chronischer Hepatitis C zuzulassen.
Ombitasvir ist ein Inhibitor des viralen NS5A-Protein, das für die Virusreplikation essenziell ist.
Paritaprevir ist ein Inhibitor der NS3/4A-Protease, die ebenfalls für die Virusreplikation essenziell ist.
Ritonavir wird als Enhancer eingesetzt.
Die Anwendung der Kombination zusammen mit weiteren Medikamenten kann die Replikation der HC-Virus hemmen und zur Eradikation Führen. Dadurch können Patienten mit chronischer Hepatitis C, die keine oder eine kompensierte Zirrhose aufweisen, geheilt werden.
Häufigste Nebenwirkungen sind Fatigue und Übelkeit-
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Ombitasvir ist ein Inhibitor des viralen NS5A-Protein, das für die Virusreplikation essenziell ist.
Ritonavir wird als Enhancer eingesetzt.
Die Anwendung der Kombination zusammen mit weiteren Medikamenten kann die Replikation der HC-Virus hemmen und zur Eradikation Führen. Dadurch können Patienten mit chronischer Hepatitis C, die keine oder eine kompensierte Zirrhose aufweisen, geheilt werden.
Häufigste Nebenwirkungen sind Fatigue und Übelkeit-
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Ospemifen von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Ospemifen (Senshio, Shionogi) zur Behandlung von postmenopausalen Frauen mit mäßig schwerer bis schwerer symptomatischer Atrophie von Vulva und Vagina zuzulassen, bei denen eine lokale Therapie nicht angezeigt ist.
Ospemifen ist ein selektiver Estrogen-Rezeptor-Modulator (SERM), der in einigen Geweben Estrogenstoffwechsel aktiviert, in einigen Geweben aber auch blockiert. Es verbessert den pH-Wert in der Vagina und das Vaginalepithel und damit belastende Symptome wie Trockenheit und Dyspareunie. Häufigste Nebenwirkungen sind Hitzewallungen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat die Substanz im Februar 2013 für diese Indikation zugelassen.
Quelle:
Mitteilung der EMA vom 21. November 2014
Ospemifen ist ein selektiver Estrogen-Rezeptor-Modulator (SERM), der in einigen Geweben Estrogenstoffwechsel aktiviert, in einigen Geweben aber auch blockiert. Es verbessert den pH-Wert in der Vagina und das Vaginalepithel und damit belastende Symptome wie Trockenheit und Dyspareunie. Häufigste Nebenwirkungen sind Hitzewallungen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat die Substanz im Februar 2013 für diese Indikation zugelassen.
Quelle:
Mitteilung der EMA vom 21. November 2014
Apremilast von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Apremilast (Otezla, Celgene) allein oder in Kombination mit DMARDs für die Behandlung von erwachsenen Patienten mit Psoriasisarthritis zuzulassen, die auf DMARDs nicht ausreichend ansprechen oder diese nicht vertragen. Außerdem empfiehlt der CHMP die Zulassung zur Behandlung von erwachsenen Patienten mit mäßig schwerer bis schwerer Psoriasis, die auf eine systemische Therapie einschließlich Methotrexat, Ciclosporin oder Psoralen plus UVA (PUVA) nicht ansprechen oder diese nicht vertragen.
Apremilast ist eine oral anwendbarer kleinmolekularer Hemmer der Phosphodiesterase-4 (PDE-4).
Die PDE-4 ist mitverantwortlich für die Hydrolyse von cAMP. Dieser intrazelluläre second Messenger kontrolliert ein Netz proinflammatorischer und inflammatorischer Mediatoren. Wird die PDE-4 gehemmt, steigen die cAMP-Spiegel, wodurch die proinflammatorischen und inflammatorischen Mediatoren moduliert werden können. Bei Gabe des PDE-4-Hemmers Apremilast kommt es zu einem Abfall von induzierbarer NO-Synthase, TNFalpha und IL23. IL-10-Spiegel steigen. Apremilast ist ein neuer Therapieansatz in der Behandlung chronisch-entzündlicher Erkrankungen, der nicht nur einen einzelnen Mediator gezielt angreift, sondern das Gleichgewicht zwischen pro- und antiinflammatorischen Signalen modulieren kann.
Wirksamkeit und Verträglichkeit wurden in drei klinischen Studien mit 1.493 Patienten mit aktiver Psoriasisarthritis untersucht. Im Vergleich zu Plazebo besserten sich die Symptome, die Zahl geschwollener und schmerzhafter Gelenke nahm ab, die Funktion besserte sicht.
Häufigste Nebenwirkungen waren Durchfall, Übelkeit und Kopfschmerzen.
Quelle:
Mitteilung der EMA vom 21. November 2014
Apremilast ist eine oral anwendbarer kleinmolekularer Hemmer der Phosphodiesterase-4 (PDE-4).
Die PDE-4 ist mitverantwortlich für die Hydrolyse von cAMP. Dieser intrazelluläre second Messenger kontrolliert ein Netz proinflammatorischer und inflammatorischer Mediatoren. Wird die PDE-4 gehemmt, steigen die cAMP-Spiegel, wodurch die proinflammatorischen und inflammatorischen Mediatoren moduliert werden können. Bei Gabe des PDE-4-Hemmers Apremilast kommt es zu einem Abfall von induzierbarer NO-Synthase, TNFalpha und IL23. IL-10-Spiegel steigen. Apremilast ist ein neuer Therapieansatz in der Behandlung chronisch-entzündlicher Erkrankungen, der nicht nur einen einzelnen Mediator gezielt angreift, sondern das Gleichgewicht zwischen pro- und antiinflammatorischen Signalen modulieren kann.
Wirksamkeit und Verträglichkeit wurden in drei klinischen Studien mit 1.493 Patienten mit aktiver Psoriasisarthritis untersucht. Im Vergleich zu Plazebo besserten sich die Symptome, die Zahl geschwollener und schmerzhafter Gelenke nahm ab, die Funktion besserte sicht.
Häufigste Nebenwirkungen waren Durchfall, Übelkeit und Kopfschmerzen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Apremilast im März 2014 für diese Indikation zugelassen.
Mitteilung der EMA vom 21. November 2014
Nintedanib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Nintedanib (Ofev, Boehringer Ingelheim) für die Behandlung von Erwachsenen mit idiopathischer Lungenfibrose zuzulassen.
Nintedanib ist ein oral applizierbarer Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Bei Patienten mit idiopathischer Lungenfibrose verringerte Nintedanib den Abfall der Vitalkapazität signifikant im Vergleich zu Plazebo. Nintedanib sollte nicht bei Patienten mit moderaten oder schweren Leberfunktionsstörungen eingesetzt werden. Bei Frauen im gebärfähigen Alter muss eine effektive Empfängnisverhütung bis drei Monate nach Ende der Therapie betrieben werden.
Häufigste Nebenwirkungen sind Durchfall, Übelkeit, Abdominalschmerzen, Erbrechen, Erhöhung der Leberenzyme, verminderter Appetit, Kopfschmerzen, Gewichtsabnahme und hoher Blutdruck.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Nintedanib im Oktober 214 für diese Indikation zugelassen.
Die EMA hat die Substanz als Vargatef im September 2014 in Kombination mit Docetaxel für die Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht kleinzelligen Bronchialkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinientherapie zur Zulassung empfohlen.
Quelle:
Mitteilung der EMA vom 21. November 2014
Nintedanib ist ein oral applizierbarer Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Bei Patienten mit idiopathischer Lungenfibrose verringerte Nintedanib den Abfall der Vitalkapazität signifikant im Vergleich zu Plazebo. Nintedanib sollte nicht bei Patienten mit moderaten oder schweren Leberfunktionsstörungen eingesetzt werden. Bei Frauen im gebärfähigen Alter muss eine effektive Empfängnisverhütung bis drei Monate nach Ende der Therapie betrieben werden.
Häufigste Nebenwirkungen sind Durchfall, Übelkeit, Abdominalschmerzen, Erbrechen, Erhöhung der Leberenzyme, verminderter Appetit, Kopfschmerzen, Gewichtsabnahme und hoher Blutdruck.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Nintedanib im Oktober 214 für diese Indikation zugelassen.
Die EMA hat die Substanz als Vargatef im September 2014 in Kombination mit Docetaxel für die Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht kleinzelligen Bronchialkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinientherapie zur Zulassung empfohlen.
Quelle:
Mitteilung der EMA vom 21. November 2014
Dasabuvir von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Dasabuvir (Exviera, Abbvie) in Kombination mit anderen Medikamenten für die Behandlung von Erwachsenen mit Hepatitis C zuzulassen.
Dasabuvir ist ein nichtnukleosidisches NS5B-Polymerasehemmer. In Kombination mit anderen Medikamenten hemmt es die Virusreplikation in infizierten Zellen und kann zur Eradikation des Virus führen. Damit kann er bei Patienten ohne Zirrhose und mit kompensierte Zirrhose zu einer Heilung der HCV-Infektion vom Genotyp 1a/1b führen.
Häufigste Nebenwirkungen sind Fatigue und Übelkeit. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Dasabuvir ist ein nichtnukleosidisches NS5B-Polymerasehemmer. In Kombination mit anderen Medikamenten hemmt es die Virusreplikation in infizierten Zellen und kann zur Eradikation des Virus führen. Damit kann er bei Patienten ohne Zirrhose und mit kompensierte Zirrhose zu einer Heilung der HCV-Infektion vom Genotyp 1a/1b führen.
Häufigste Nebenwirkungen sind Fatigue und Übelkeit. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Secukinumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Secukinumab (Cosentyx, Novartis) für die Behandlung von Erwachsenen mit mäßig schwerer bis schwerer Psoriasis zuzulassen, bei denen eine systemische Therapie angezeigt ist.
Secukinumab ist ein humaner monoklonaler Antikörper gegen Interleukin-17A, der parenteral appliziert werden muss. Er hemmt die Bindung des Zytokins an seinen Rezeptor und verhindert dadurch die Freisetzung von proinflammatorisch wirkenden Zytokinen, Chemokinen und Mediatoren, die Zellen und Gewebe schädigen können.
Secukinumab ist bei Patienten mit Psoriasis wirksam, und zwar sowohl bei therapienaiven Patienten als auch bei Patienten, die mit TNF-alpha-Blockern oder anderen Biologika vorbehandelt waren und/oder bei denen diese Medikamente versagt hatten.
Häufigste Nebenwirkungen in den Studien waren Nasopharyngitis und Rhinitis. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Secukinumab ist ein humaner monoklonaler Antikörper gegen Interleukin-17A, der parenteral appliziert werden muss. Er hemmt die Bindung des Zytokins an seinen Rezeptor und verhindert dadurch die Freisetzung von proinflammatorisch wirkenden Zytokinen, Chemokinen und Mediatoren, die Zellen und Gewebe schädigen können.
Secukinumab ist bei Patienten mit Psoriasis wirksam, und zwar sowohl bei therapienaiven Patienten als auch bei Patienten, die mit TNF-alpha-Blockern oder anderen Biologika vorbehandelt waren und/oder bei denen diese Medikamente versagt hatten.
Häufigste Nebenwirkungen in den Studien waren Nasopharyngitis und Rhinitis. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Eliglustat von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 empfohlen, Eliglustat (Cerdelga, Genzyme) bei Erwachsenen mit Gaucher-Krankheit Typ 1 zuzulassen, die schlechte, intermediäre oder extensive Metabolisierer über CYP2D6 sind.
Eliglustat war im Dezember 2007 als Orphan Drug anerkannt worden. Es ist ein potenter und spezifischer Inhibitor der Glucosylceramid-Synthase und wirkt als Substrat-Reduktionstherapie (STR für Patienten mit Gaucher-Krankheit vom Typ 1, weil es die Bildung von Glucocerebrosiden verringert. Die Wirkung ist allerdings schwächer als eine Enzymersatztherapie des M. Gaucher. Vorteilhaft ist jedoch, dass es oral anwendbar ist.
Durch die Senkung der Glucocerebrosid-Spiegel verkleinern sich Leber und Milz, hämatologische Parameter und Parameter des Knochenstoffwechsels bessern sich. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Durchfall, Bauchschmerzen, Blähungen, Arthralgie und Fatigue.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Eliglustat war im Dezember 2007 als Orphan Drug anerkannt worden. Es ist ein potenter und spezifischer Inhibitor der Glucosylceramid-Synthase und wirkt als Substrat-Reduktionstherapie (STR für Patienten mit Gaucher-Krankheit vom Typ 1, weil es die Bildung von Glucocerebrosiden verringert. Die Wirkung ist allerdings schwächer als eine Enzymersatztherapie des M. Gaucher. Vorteilhaft ist jedoch, dass es oral anwendbar ist.
Durch die Senkung der Glucocerebrosid-Spiegel verkleinern sich Leber und Milz, hämatologische Parameter und Parameter des Knochenstoffwechsels bessern sich. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Durchfall, Bauchschmerzen, Blähungen, Arthralgie und Fatigue.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Sonntag, 23. November 2014
Voraxapar von der EMA zur Zulassung empfohlen
Der CHMP der EMA hat in seiner Sitzung vom November 2014 empfohlen, Vorapaxar (Zontivity, MSD Sharp & Dohme) für die Reduktion atherothrombotischer Ereignisse bei Erwachsenen mit einem Herzinfarkt in der Anamnese in Kombination mit Acetylsalicylsäure oder gegebenenfalls mit Clopidogrel zuzulassen.
Vorapaxar ist ein Antagonist am Protease-aktivierten Rezeptor-1 (PAR-1). Über diesen Rezeptor veranlasst Thrombin die Fibrin-Bildung und aktiviert die Thrombozyten. In Gegenwart von Vorapaxar unterbleibt dies. Es ist also ein Thrombin-Rezeptorantagonist, der die Thrombozytenfunktion hemmt. Vorapaxar hemmt die durch TRAP (Thrombin-Rezeptor-Agonist-Peptid) induzierte Thrombozytenaggregation ohne andere Blutgerinnungsparameter zu beeinflussen. Die durch Adenosin, Kollagen oder ein Thromboxanmimetikum induzierte Gerinnung wird durch Vorapaxar nicht gehemmt.
Häufigste unerwünschte Wirkungen sind Blutungen, wie Hämatome oder Nasenbluten.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Vorapaxar ist ein Antagonist am Protease-aktivierten Rezeptor-1 (PAR-1). Über diesen Rezeptor veranlasst Thrombin die Fibrin-Bildung und aktiviert die Thrombozyten. In Gegenwart von Vorapaxar unterbleibt dies. Es ist also ein Thrombin-Rezeptorantagonist, der die Thrombozytenfunktion hemmt. Vorapaxar hemmt die durch TRAP (Thrombin-Rezeptor-Agonist-Peptid) induzierte Thrombozytenaggregation ohne andere Blutgerinnungsparameter zu beeinflussen. Die durch Adenosin, Kollagen oder ein Thromboxanmimetikum induzierte Gerinnung wird durch Vorapaxar nicht gehemmt.
Häufigste unerwünschte Wirkungen sind Blutungen, wie Hämatome oder Nasenbluten.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 21. November 2014
Ustekinumab: Rote-Hand-Brief wegen exfoliativer Dermatitis
Der Hersteller informiert in einem Rote-Hand-Brief über das Risiko der exfoliativen Dermatitis im Zusammenhang mit der Behandlung mit Ustekinumab (Stelara). Auch eine Exfoliation der Haut ohne weitere Symptome einer exfoliativen Dermatitis wurde beschrieben. Bei Patienten mit Plaque-Psoriasis kann sich auch im Verlauf der Erkrankung eine erythrodermische Psoriasis entwickeln, die klinisch nicht von einer exfoliativen Dermatitis zu unterscheiden ist.
Wenn entsprechende Symptome auftreten, muss unverzüglich eine angemessene Therapie eingeleitet werden. Wird ein Zusammenhang mit Ustekinumab vermutet, soll die Therapie beendet werden. Die Patienten sollten über die möglichen Symptome (z. B. stärkere Rötung, Schälen der Haut über eine größere Fläche des Körpers) informiert werden. Die Fachinformation wird aktualisiert.
Quelle:
AkdÄ Drug Safety Mail vom 21. November 2014
Wenn entsprechende Symptome auftreten, muss unverzüglich eine angemessene Therapie eingeleitet werden. Wird ein Zusammenhang mit Ustekinumab vermutet, soll die Therapie beendet werden. Die Patienten sollten über die möglichen Symptome (z. B. stärkere Rötung, Schälen der Haut über eine größere Fläche des Körpers) informiert werden. Die Fachinformation wird aktualisiert.
Quelle:
AkdÄ Drug Safety Mail vom 21. November 2014
Donnerstag, 20. November 2014
Ledipasvir plus Sofosbuvir von der EU-Kommission zugelassen
Die EU-Kommission hat am 18. November 2014 Ledipasvir in Kombination mit Sofosbuvir (Harvoni, Gilead) zur Behandlung der chronischen Hepatitis C zugelassen.
Ledipasvir ist ein HCV-NS5A-Inhibitor, die Effekte beruhen auf der Bindung an das virale Protein NS5A (Non-Structural Protein 5A). Im Unterschied zu anderen antiviralen HCV-Medikamenten handelt es sich beim NS5A nicht um ein Enzym, sondern um ein Phosphoprotein, das bei der RNS-Replikation und beim Assembly eine Rolle spielt.
Sofosbuvir (Sovaldi, Gilead Sciences) ist ein oral anwendbarer nucleotidischer Inhibitor des viralen Enzyms RNA-abhängige RNA-Polymerase NS5B. Der aktive Wirkstoff wird in die RNA integriert und führt zu einem Kettenabbruch. Damit wird die Virusvermehrung unterbunden.Mit Sofosbuvir steht seit Ende 2013die erste Interferon-freie Therapiemöglichkeit der Hepatitis C zur Verfügung.
Wirksamkeit und Verträglichkeit der Kombination wurden in drei klinischen Studien mit 1.518 therapienaiven oder therapieresistenten Patienten untersucht.
Quelle:
Mitteilung der EU-Kommission
Ledipasvir ist ein HCV-NS5A-Inhibitor, die Effekte beruhen auf der Bindung an das virale Protein NS5A (Non-Structural Protein 5A). Im Unterschied zu anderen antiviralen HCV-Medikamenten handelt es sich beim NS5A nicht um ein Enzym, sondern um ein Phosphoprotein, das bei der RNS-Replikation und beim Assembly eine Rolle spielt.
Sofosbuvir (Sovaldi, Gilead Sciences) ist ein oral anwendbarer nucleotidischer Inhibitor des viralen Enzyms RNA-abhängige RNA-Polymerase NS5B. Der aktive Wirkstoff wird in die RNA integriert und führt zu einem Kettenabbruch. Damit wird die Virusvermehrung unterbunden.Mit Sofosbuvir steht seit Ende 2013die erste Interferon-freie Therapiemöglichkeit der Hepatitis C zur Verfügung.
Wirksamkeit und Verträglichkeit der Kombination wurden in drei klinischen Studien mit 1.518 therapienaiven oder therapieresistenten Patienten untersucht.
Quelle:
Mitteilung der EU-Kommission
Samstag, 8. November 2014
Dimethylfumarat: PRAC informiert über ersten Fall einer PML
Das PRAC berichtet über einen PML-Fall unter Therapie mit Dimethylfumarat (Tecfidera).
Unter der Behandlung mit Dimethylfumarat wurde erstmal ein tödlich endender Fall einer progressiven multifokalen Leukenzephalopathie (PML) beobachtet. Er trat bei einem Patienten nach langer Therapie mit Dimethylfumarat auf, bei dem es zu einer schweren, lang anhaltenden Lymphophenie, einer bekannten Nebenwirkung der Substanz gekommen war.
Wegen der Lymphopenie werden Kontrollen des Differenzialblutbilds empfohlen vor Behandlungsbeginn sowie nach sechsmonatiger Behandlung und anschließend alle sechs bis zwölf Monate und wenn klinisch indiziert empfohlen.
Aufgrund des Risikos einer opportunistischen Infektion bei Fortführung der Therapie trotz schwerer anhaltender Lymphopenie empfiehlt die AkdÄ auch bei Behandlung mit Tecfidera® Kontrollen des Blutbilds und ggf. Absetzen analog zu den Empfehlungen zu Fumaderm®.
Quellen:
Mitteilung der EMA vom 7. November 2014
AkDAe Drug Safety Mail vom 7. November 2014
Unter der Behandlung mit Dimethylfumarat wurde erstmal ein tödlich endender Fall einer progressiven multifokalen Leukenzephalopathie (PML) beobachtet. Er trat bei einem Patienten nach langer Therapie mit Dimethylfumarat auf, bei dem es zu einer schweren, lang anhaltenden Lymphophenie, einer bekannten Nebenwirkung der Substanz gekommen war.
Wegen der Lymphopenie werden Kontrollen des Differenzialblutbilds empfohlen vor Behandlungsbeginn sowie nach sechsmonatiger Behandlung und anschließend alle sechs bis zwölf Monate und wenn klinisch indiziert empfohlen.
Aufgrund des Risikos einer opportunistischen Infektion bei Fortführung der Therapie trotz schwerer anhaltender Lymphopenie empfiehlt die AkdÄ auch bei Behandlung mit Tecfidera® Kontrollen des Blutbilds und ggf. Absetzen analog zu den Empfehlungen zu Fumaderm®.
Quellen:
Mitteilung der EMA vom 7. November 2014
AkDAe Drug Safety Mail vom 7. November 2014
Ivabradin: PRAC empfiehlt Maßnahmen zur Verminderung kardialer Risiken
Das Pharmacovigilance Risk Assessment Committee (PRAC) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2014 verschiedene Maßnahmen empfohlen, um das kardiale Risiko von Ivabradin (Procorolan zu reduzieren.
Patienten, die mit Ivabradin behandelt werden, haben ein erhöhtes Risiko für Vorhofflimmern. Deshalb empfahl das PRAC nun, Patienten, die mit Ivabradin behandelt werden, sorgfältig auf das Auftreten eines Vorhofflimmerns zu überwachen. Bei Patienten mit Angina pectoris soll Ivabradin nur zur Linderung der Symptome eingesetzt werden. Die bislang vorliegenden Daten belegen keinen Nutzen der Substanz hinsichtlich einer Reduktion von Herzinfarkten oder kardiovaskulär bedingten Todesfällen.
Nach den vorliegenden Daten ist unklar, ob eine höhere Dosierung das Risiko für ein Vorhofflimmern erhöht. Dennoch betont das PRAC, dass die Inititaldosis zur Behandlung der Angina nicht höher als zweimal täglich 5 mg und die maximale Dosis nicht höher als zweimal täglich 7,5 mg sein sollte.
Die PRAC-Empfehlungen werden nun an den Ausschuss für Humanarzneimittel (CHMP) weiter geleitet.
Quelle:
Pressemitteilung der EMA vom 7. November 2014
Patienten, die mit Ivabradin behandelt werden, haben ein erhöhtes Risiko für Vorhofflimmern. Deshalb empfahl das PRAC nun, Patienten, die mit Ivabradin behandelt werden, sorgfältig auf das Auftreten eines Vorhofflimmerns zu überwachen. Bei Patienten mit Angina pectoris soll Ivabradin nur zur Linderung der Symptome eingesetzt werden. Die bislang vorliegenden Daten belegen keinen Nutzen der Substanz hinsichtlich einer Reduktion von Herzinfarkten oder kardiovaskulär bedingten Todesfällen.
Nach den vorliegenden Daten ist unklar, ob eine höhere Dosierung das Risiko für ein Vorhofflimmern erhöht. Dennoch betont das PRAC, dass die Inititaldosis zur Behandlung der Angina nicht höher als zweimal täglich 5 mg und die maximale Dosis nicht höher als zweimal täglich 7,5 mg sein sollte.
Die PRAC-Empfehlungen werden nun an den Ausschuss für Humanarzneimittel (CHMP) weiter geleitet.
Quelle:
Pressemitteilung der EMA vom 7. November 2014
Donnerstag, 6. November 2014
Ramucirumab: FDA lässt Kombination mit Paclitaxel zu
Die FDA hat die Zulassung von Ramucirumab (Cyramza, Lilly) erweitert. Es kann nun auch in Kombination mit Paclitaxel zur Behandlung von Patienten mit fortgeschrittenem Magenkarzinom oder Adenokarzinom der gastroösophagealen Junktion eingesetzt werden.
Die Zulassungserweiterung basiert auf einer multizentrischen doppelblinden plazebokontrollierten Studie mit 665 vorbehandelten Patienten . Sie erhielten Ramucirumab plus Paclitaxel oder Plazebo plus Paclitaxel. Das mediane Überleben wurde von 7,4 auf 9,6 Monate verlängert.
Quelle:
Mitteilung der FDA vom 5. November 2014
Die Zulassungserweiterung basiert auf einer multizentrischen doppelblinden plazebokontrollierten Studie mit 665 vorbehandelten Patienten . Sie erhielten Ramucirumab plus Paclitaxel oder Plazebo plus Paclitaxel. Das mediane Überleben wurde von 7,4 auf 9,6 Monate verlängert.
Quelle:
Mitteilung der FDA vom 5. November 2014
Meningokokkenimpfstoff: FDA lässt ersten Impfstoff gegen Serogruppe B zu
Die Food and Drug Administration (FDA) hat erstmals einen Meningokokkenimpfstoff (Trumenba, Wyeth-Pfizer) gegen N. mengitidis Serogruppe B zugelassen. Der beschleunigt zugelassene Impfstoff kann bei Personen zwischen 10 und 25 Jahren eingesetzt werden.
In drei randomisierten Studien in Europa und den USA mit etwa 2.800 Adoleszenten konnte gezeigt werden, dass bei 82 % der Probanden nach dreimaliger Impfung mit Trumenba Antikörper vorlagen, die vier Stämme von Neisseria meningitidis Serogruppe B abtöteten. Häufigste Nebenwirkungen waren Schmerzen und Schwellungen an der Injektionsstelle, Kopfschmerzen, Durchfall, Muskel- und Gelenkschmerzen sowie Fatigue.
Quelle:
Pressemitteilung der FDA vom 29. Oktober 2014
In drei randomisierten Studien in Europa und den USA mit etwa 2.800 Adoleszenten konnte gezeigt werden, dass bei 82 % der Probanden nach dreimaliger Impfung mit Trumenba Antikörper vorlagen, die vier Stämme von Neisseria meningitidis Serogruppe B abtöteten. Häufigste Nebenwirkungen waren Schmerzen und Schwellungen an der Injektionsstelle, Kopfschmerzen, Durchfall, Muskel- und Gelenkschmerzen sowie Fatigue.
Quelle:
Pressemitteilung der FDA vom 29. Oktober 2014
Dienstag, 4. November 2014
Enzalutamid: EMA empfiehlt Indikationserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2014 empfohlen, die Zulassung von Enzalutamid (_Xtandi, Astellas) zu erweitern. Es soll nun auch für die Behandlung von Männern mit kastrationsresistentem Prostatakarzinom eingesetzt werden können, die nach Versagen einer Androgenunterdrückungstherapie asymptomatisch sind oder nur leichte Symptome haben und bei denen eine Chemotherapie nicht angezeigt ist.
Quelle:
Mitteilung der EMA vom 24. Oktober 2014
Quelle:
Mitteilung der EMA vom 24. Oktober 2014
Simoctocog alfa von der EU-Kommission zugelassen
Die EU-Kommission hat Simoctocog alfa (Nuwiq, Octapharma)für die Prophylaxe und Therapie von Erwachsenen und Kindern mit Hämophilie A zugelassen.
Simoctocog alfa ist ein rekombinanter Faktor VIII, mit dem eine Substitutionstherapie bei Faktor-VIII-Mangel möglich ist. Es ist der erste Faktor VIII, der biotechnisch mit Hilfe einer menschlichen Zelllinie hergestellt wird. Er besitzt deshalb ausschließlich Glykosylierungen, wie sie typisch beim Menschen sind. Pharmakokinetik und Nutzen von Simoctocog alfa in Prophylaxe und Therapie von Blutungen und die hämostatische Wirksamkeit bei operativen Eingriffen wurde in fünf Studien mit 74 Erwachsenen und 61 Kindern bewertet. Nebenwirkungen wurden bislang nicht gesehen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Simoctocog alfa ist ein rekombinanter Faktor VIII, mit dem eine Substitutionstherapie bei Faktor-VIII-Mangel möglich ist. Es ist der erste Faktor VIII, der biotechnisch mit Hilfe einer menschlichen Zelllinie hergestellt wird. Er besitzt deshalb ausschließlich Glykosylierungen, wie sie typisch beim Menschen sind. Pharmakokinetik und Nutzen von Simoctocog alfa in Prophylaxe und Therapie von Blutungen und die hämostatische Wirksamkeit bei operativen Eingriffen wurde in fünf Studien mit 74 Erwachsenen und 61 Kindern bewertet. Nebenwirkungen wurden bislang nicht gesehen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Dienstag, 28. Oktober 2014
Antihämophiler Faktor von der FDA zugelassen
Die Food and Drug Administration (FDA) hat rekombinanten antihämophilen Faktor (Obizur, Baxter) für die Behandlung von Blutungsepisoden bei Erwachsenen mit erworbener Hämophilie A zugelassen.
Obizur enthält ein rekombinantes Analogon von Schweine-Faktor VIII. Schweine-Faktor VIII ist dem menschlichen Faktor VIII sehr ähnlich. Es wird deshalb verwendet, weil es die Blutgerinnung beim Menschen fördert, gleichzeitig aber weniger stark von Antikörpern gegen humanen Faktor VIII inaktiviert wird, die bei Patienten mit erworbener Hämophilie A vorliegen.
Wirksamkeit und Verträglichkeit von Obizur wurden in einer klinischen Studie an 29 Patienten erhoben.
Quelle:
Pressemitteilung der FDA vom 24. Oktober 2014
Obizur enthält ein rekombinantes Analogon von Schweine-Faktor VIII. Schweine-Faktor VIII ist dem menschlichen Faktor VIII sehr ähnlich. Es wird deshalb verwendet, weil es die Blutgerinnung beim Menschen fördert, gleichzeitig aber weniger stark von Antikörpern gegen humanen Faktor VIII inaktiviert wird, die bei Patienten mit erworbener Hämophilie A vorliegen.
Wirksamkeit und Verträglichkeit von Obizur wurden in einer klinischen Studie an 29 Patienten erhoben.
Quelle:
Pressemitteilung der FDA vom 24. Oktober 2014
Sonntag, 26. Oktober 2014
Afamelanotid von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2014 empfohlen, Afamelanotid (Scenesse, Clinuvel) zur Prävention der Phototoxizität bei Erwachsenen mit erythropoetischer Porphyrie (EPP) zuzulassen.
Afamelatonid ist ein synthetisches Analogon von alpha-Melanozyten-stimulierendem Hormon, das als Melanocortin-1-Rezeptoragonist wirkt und so die Melanogenese stimuliert. Dies führt zu einer verstärkten Pigmentierung der Haut.
Afamelanotid verringert die Lichtempfindlichkeit, was es den EPP-Patienten ermöglicht, sich länger dem Tages- oder Sonnenlicht auszusetzen. Weil sie sich mehr im Freien aufhalten können, verbessert sich die Lebensqualität. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Nasopharyngitis, Migräne, Bauchschmerzen, Fatigue, Lethargie und Somnolenz. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 23. Oktober 2014
Afamelatonid ist ein synthetisches Analogon von alpha-Melanozyten-stimulierendem Hormon, das als Melanocortin-1-Rezeptoragonist wirkt und so die Melanogenese stimuliert. Dies führt zu einer verstärkten Pigmentierung der Haut.
Afamelanotid verringert die Lichtempfindlichkeit, was es den EPP-Patienten ermöglicht, sich länger dem Tages- oder Sonnenlicht auszusetzen. Weil sie sich mehr im Freien aufhalten können, verbessert sich die Lebensqualität. Häufigste Nebenwirkungen sind Kopfschmerzen, Übelkeit, Nasopharyngitis, Migräne, Bauchschmerzen, Fatigue, Lethargie und Somnolenz. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 23. Oktober 2014
Olaparib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2014 empfohlen, Olaparib (Lynparza, AstraZeneca) für die Erhaltungstherapie erwachsener Patientinnen zuzulassen, die unter einem Platin-sensitivem Rezidiv (PSR) eines BRCA-mutierten (Keimbahn und/oder somatisch), high grade serösen, epithelialen Ovarial-, Eileiter oder primären Peritonealkarzinoms leiden und auf eine Platin-basierte Chemotherapie vollständig oder teilweise ansprechen.
Olaparaib ist ein Hemmer von PARP-1, PARP-2 und PARP-3. Die zelluläre DNS ist ständig schädigenden Einflüssen ausgesetzt, deren Auswirkungen durch Reparaturenzyme wieder beseitigt werden können. An der homologen Rekombination sind Tumorsuppressorproteine wie BRCA1 und BRCA2 beteiligt. Zu den Reparaturenzymen gehört ferner die große Familie der Poly-(ADP-ribose)-Ppolymerasen (PARPs), von denen PARP-1 das wichtigste Enzym ist. Es ist an der Reparatur von Einzelstrangbrüchen der DNS beteiligt. Die verschiedenen Reparaturmechanismen können sich gegenseitig ersetzen, fällt ein Mechanismus aus, können DNS-Schäden normalerweise durch weitere Mechanismen wieder repariert werden. So funktioniert beispielsweise bei Zellen mit mutierten BRCA1- oder -2-Genen der Reparaturmechanismus nicht mehr. Wird PARP bei solchen Zellen gehemmt, sterben die Zellen ab. Dieses Vorgehen wird auch als synthetische Letalität bezeichnet.
Olaparib verbesserte in einer Phase-II-Studie das PFS bei Frauen mit Platin-empfindlichen, rezidivierten hochgradig serösen Ovarial-, Eileiter- und Peritonealkarzinomen mit BRCA-Mutationen im Vergleich zu Plazebo von 4,3 auf 11,2 Monate. .
Häufigste Nebenwirkungen waren Übelkeit, Erbrechen, Durchfall, Dyspepsie, Fatigue, Kopfschmerzen, Dysgeusie, verminderter Appetit, Benommenheit, Anämie, Neutropenie und Lymphopenie. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 23. Oktober 2014
Olaparaib ist ein Hemmer von PARP-1, PARP-2 und PARP-3. Die zelluläre DNS ist ständig schädigenden Einflüssen ausgesetzt, deren Auswirkungen durch Reparaturenzyme wieder beseitigt werden können. An der homologen Rekombination sind Tumorsuppressorproteine wie BRCA1 und BRCA2 beteiligt. Zu den Reparaturenzymen gehört ferner die große Familie der Poly-(ADP-ribose)-Ppolymerasen (PARPs), von denen PARP-1 das wichtigste Enzym ist. Es ist an der Reparatur von Einzelstrangbrüchen der DNS beteiligt. Die verschiedenen Reparaturmechanismen können sich gegenseitig ersetzen, fällt ein Mechanismus aus, können DNS-Schäden normalerweise durch weitere Mechanismen wieder repariert werden. So funktioniert beispielsweise bei Zellen mit mutierten BRCA1- oder -2-Genen der Reparaturmechanismus nicht mehr. Wird PARP bei solchen Zellen gehemmt, sterben die Zellen ab. Dieses Vorgehen wird auch als synthetische Letalität bezeichnet.
Olaparib verbesserte in einer Phase-II-Studie das PFS bei Frauen mit Platin-empfindlichen, rezidivierten hochgradig serösen Ovarial-, Eileiter- und Peritonealkarzinomen mit BRCA-Mutationen im Vergleich zu Plazebo von 4,3 auf 11,2 Monate. .
Häufigste Nebenwirkungen waren Übelkeit, Erbrechen, Durchfall, Dyspepsie, Fatigue, Kopfschmerzen, Dysgeusie, verminderter Appetit, Benommenheit, Anämie, Neutropenie und Lymphopenie. Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 23. Oktober 2014
Dienstag, 21. Oktober 2014
Ibrutinib von der EU-Kommission zugelassen
Die EU-Kommission hat Ibrutinib (Imbruvica, Janssen-Cilag) für die Behandlung von rezidiviertem oder refraktärem Mantelzell-Lymphom (MCL) und chronischer lymphatischer Leukämie (CLL) zugelassen.
Ibrutinib hemmt die Bruton-Tyrosinkinase (BTK), die wichtig für das Wachstum und Überleben von B-Zellen ist. Ibrutinib tötet maligne B-Zellen ab, greift an gesunden B-Zellen jedoch nicht an.
Bei Patienten mit chronischer CLL verbesserte Ibrutinib das progressionsfreie Überleben, wie in einer Studie im Vergleich mit Ofatumumab gezeigt werden konnte. Bei Patienten mit MCL erhöht es nach Ergebnissen einer einarmigen Studie die Gesamtansprechrate und die Dauer des Ansprechens.
Häufigste unerwünschte Wirkungen sind Pneumonie, Infektionen der oberen Atemwege, Sinusitis, Neutropenie, Thrombozytopenie, Anämie, Benommenheit, Kopfschmerzen, Blutungen, Petechien, Durchfall, Erbrechen, Stomatitis, Übelkeit, Verstopfung, Hautausschlag, Arthralgie, muskuloskeletale Schmerzen, Fieber und periphere Ödeme.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Ibrutinib im November 2013 für die Behandlung des MLC und im Februar 2014 für die CLL zugelassen.
Quelle:
Biospace vom 17.10.2014
Ibrutinib hemmt die Bruton-Tyrosinkinase (BTK), die wichtig für das Wachstum und Überleben von B-Zellen ist. Ibrutinib tötet maligne B-Zellen ab, greift an gesunden B-Zellen jedoch nicht an.
Bei Patienten mit chronischer CLL verbesserte Ibrutinib das progressionsfreie Überleben, wie in einer Studie im Vergleich mit Ofatumumab gezeigt werden konnte. Bei Patienten mit MCL erhöht es nach Ergebnissen einer einarmigen Studie die Gesamtansprechrate und die Dauer des Ansprechens.
Häufigste unerwünschte Wirkungen sind Pneumonie, Infektionen der oberen Atemwege, Sinusitis, Neutropenie, Thrombozytopenie, Anämie, Benommenheit, Kopfschmerzen, Blutungen, Petechien, Durchfall, Erbrechen, Stomatitis, Übelkeit, Verstopfung, Hautausschlag, Arthralgie, muskuloskeletale Schmerzen, Fieber und periphere Ödeme.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Ibrutinib im November 2013 für die Behandlung des MLC und im Februar 2014 für die CLL zugelassen.
Quelle:
Biospace vom 17.10.2014
Montag, 20. Oktober 2014
Pirfenidon von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Pirfenidon (Esbriet, InterMune) beschleunigt für die Behandlung von Patienten mit idiopathischer Lungenfibrose als Orphan Drug zugelassen. In der EU ist die Substanz seit März 2011 als Orphan Drug zugelassen.
Der Wirkungsmechanismus von Pirfenidon ist noch nicht vollständig aufgeklärt. Die vorliegenden Daten deuten darauf hin, dass Pirfenidon sowohl antifibrotische als auch antiinflammatorische
Eigenschaften in verschiedenen In-vitro-Systemen und Tiermodellen der Lungenfibrose entfaltet.
Pirfenidon dämpft die Fibroblastenproliferation, die Produktion von fibroseassoziierten Proteinen und
Zytokinen und die erhöhte Biosynthese und Ansammlung von extrazellulärer Matrix als Reaktion auf
Zytokin-Wachstumsfaktoren wie zum Beispiel den transformierenden Wachstumsfaktor-beta (TGF-β) und den Plättchenwachstumsfaktor (PDGF).
Wirksamkeit und Verträglichkeit wurden in drei klinischen Studien mit 1247 Patienten untersucht. Mit Pirfenidon verringerte sich der Abfall der forcierten Einsekundenkapazität signifikant weniger als mit Plazebo. Pirfendon sollte nicht bei Patienten mit schweren Leber- und Nierenfunktionsstörungen eingesetzt werden. Sonneneinstrahlung ist bei der Therapie zu meiden.
Quelle:
Pressemeldung der FDA vom 15. Oktober 2014
Der Wirkungsmechanismus von Pirfenidon ist noch nicht vollständig aufgeklärt. Die vorliegenden Daten deuten darauf hin, dass Pirfenidon sowohl antifibrotische als auch antiinflammatorische
Eigenschaften in verschiedenen In-vitro-Systemen und Tiermodellen der Lungenfibrose entfaltet.
Pirfenidon dämpft die Fibroblastenproliferation, die Produktion von fibroseassoziierten Proteinen und
Zytokinen und die erhöhte Biosynthese und Ansammlung von extrazellulärer Matrix als Reaktion auf
Zytokin-Wachstumsfaktoren wie zum Beispiel den transformierenden Wachstumsfaktor-beta (TGF-β) und den Plättchenwachstumsfaktor (PDGF).
Wirksamkeit und Verträglichkeit wurden in drei klinischen Studien mit 1247 Patienten untersucht. Mit Pirfenidon verringerte sich der Abfall der forcierten Einsekundenkapazität signifikant weniger als mit Plazebo. Pirfendon sollte nicht bei Patienten mit schweren Leber- und Nierenfunktionsstörungen eingesetzt werden. Sonneneinstrahlung ist bei der Therapie zu meiden.
Quelle:
Pressemeldung der FDA vom 15. Oktober 2014
Ledipasvir plus Sofosbuvir von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Ledipasvir in Kombination mit Sofosbuvir (Harvoni, Gilead) zur Behandlung der chronischen Hepatitis C als Breakthrough-Therapie zugelassen.
Ledipasvir ist ein HCV-NS5A-Inhibitor, die Effekte beruhen auf der Bindung an das virale Protein NS5A (Non-Structural Protein 5A). Im Unterschied zu anderen antiviralen HCV-Medikamenten handelt es sich beim NS5A nicht um ein Enzym, sondern um ein Phosphoprotein, das bei der RNS-Replikation und beim Assembly eine Rolle spielt.
Sofosbuvir (Sovaldi, Gilead Sciences) ist ein oral anwendbarer nucleotidischer Inhibitor des viralen Enzyms RNA-abhängige RNA-Polymerase NS5B. Der aktive Wirkstoff wird in die RNA integriert und führt zu einem Kettenabbruch. Damit wird die Virusvermehrung unterbunden.Mit Sofosbuvir steht seit Ende 2013die erste Interferon-freie Therapiemöglichkeit der Hepatitis C zur Verfügung.
Wirksamkeit und Verträglichkeit der Kombination wurden in drei klinischen Studien mit 1.518 therapienaiven oder therapieresistenten Patienten untersucht.
Quelle:
Netupitant plus Palonosetron von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Netupitant in Kombination mit Palonosetron (Akynzeo, Eisai) zur Behandlung von akuter Chemotherapie-induzierter Übelkeit und Erbrechen zugelassen.
Die fixe Kombination aus dem Neurokinin-1 (NK1)-Rezeptorantagonisten Netupitant und dem 5-HT3-Rezeptorantagonisten Palonosetron erwies sich verglichen mit oralem Palonosetron allein in zwei Phase-III-Studien zur Vorbeugung von chemotherapieinduzierter Übelkeit und Erbrechen bei moderat emetogener Chemotherapie als wirksamer. Palonosetron ist als Monotherapie seit 2008 im Handel. Netupitant, wie Apreptitant ein NK-Rezeptorantagonist, war bisher nicht verfügbar.
Häufige Nebenwirkungen der Kombination waren Kopfschmerzen, Asthenie, Fatigue, Dyspepsie und Verstopfung.
Quelle:
Pressemitteilung der FDA vom 10. Oktober 2014
Die fixe Kombination aus dem Neurokinin-1 (NK1)-Rezeptorantagonisten Netupitant und dem 5-HT3-Rezeptorantagonisten Palonosetron erwies sich verglichen mit oralem Palonosetron allein in zwei Phase-III-Studien zur Vorbeugung von chemotherapieinduzierter Übelkeit und Erbrechen bei moderat emetogener Chemotherapie als wirksamer. Palonosetron ist als Monotherapie seit 2008 im Handel. Netupitant, wie Apreptitant ein NK-Rezeptorantagonist, war bisher nicht verfügbar.
Häufige Nebenwirkungen der Kombination waren Kopfschmerzen, Asthenie, Fatigue, Dyspepsie und Verstopfung.
Quelle:
Pressemitteilung der FDA vom 10. Oktober 2014
Freitag, 17. Oktober 2014
Nintedanib von FDA für idiopathische Lungenfibrose zugelassen
Die Food and Drug Administration (FDA) hat den Multikinase-Inhibitor Nintedanib (Ofev, Boehringer Ingelheim) für die Behandlung der idiopathischen Lungenfibrose beschleunigt als Orphan Drug zugelassen.
Nintedanib ist ein Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Bei Patienten mit idiopathischer Lungenfibrose verringerte Nintedanib den Abfall der Vitalkapazität signifikant im Vergleich zu Plazebo. Nintedanib sollte nicht bei Patienten mit moderaten oder schweren Leberfunktionsstörungen eingesetzt werden. Bei Frauen im gebärfähigen Alter muss eine effektive Empfängnisverhütung bis drei Monate nach Ende der Therapie betrieben werden.
Häufigste Nebenwirkungen sind Durchfall, Übelkeit, Abdominalschmerzen, Erbrechen, Erhöhung der Leberenzyme, verminderter Appetit, Kopfschmerzen, Gewichtsabnahme und hoher Blutdruck.
Quelle
Pressemitteilung der FDA vom 15. Oktober 2014
Nintedanib ist ein Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Bei Patienten mit idiopathischer Lungenfibrose verringerte Nintedanib den Abfall der Vitalkapazität signifikant im Vergleich zu Plazebo. Nintedanib sollte nicht bei Patienten mit moderaten oder schweren Leberfunktionsstörungen eingesetzt werden. Bei Frauen im gebärfähigen Alter muss eine effektive Empfängnisverhütung bis drei Monate nach Ende der Therapie betrieben werden.
Häufigste Nebenwirkungen sind Durchfall, Übelkeit, Abdominalschmerzen, Erbrechen, Erhöhung der Leberenzyme, verminderter Appetit, Kopfschmerzen, Gewichtsabnahme und hoher Blutdruck.
Quelle
Pressemitteilung der FDA vom 15. Oktober 2014
Montag, 13. Oktober 2014
Ponatinib: PRAC empfiehlt Warnung vor arteriellen Blutgerinnseln
Das Pharmacovigilance Risk Assessment Committee (PRAC) der Europäischen Zulassungsbehörde (EMA) empfiehlt für Ponatinib (Iclusig) die Aufnahme eines Warnhinweises zum Risiko von Blutgerinnseln und Verstopfung von Arterien. Der Nutzen von Ponatinib überwiegt nach wie vor seine Risiken bei der Behandlung von Patienten mit CML und ALL. Patienten und Ärzte sollen jedoch deutlich auf das erhöhte Risiko für Blutgerinnsel und verstopfte Arterien hingewiesen werden.
Das Committee for Medicinal Products for Human Use (CHMP) hat in seiner Oktobersitzung diese PRAC-Empfehlungen bestätigt, die nun von der EU-Kommission endgültig entscheiden werden müssen.
Quelle
Mitteilung der EMA vom 10. Oktober 2014
Mitteilung der EMA vom 24.Oktober 2014
Das Committee for Medicinal Products for Human Use (CHMP) hat in seiner Oktobersitzung diese PRAC-Empfehlungen bestätigt, die nun von der EU-Kommission endgültig entscheiden werden müssen.
Quelle
Mitteilung der EMA vom 10. Oktober 2014
Mitteilung der EMA vom 24.Oktober 2014
Testosteron: PRAC sieht kein erhöhtes Risiko für kardiale Probleme
Das Pharmacovigilance Risk Assessment Committee (PRAC) der EMA sieht für Testosteron-haltige Arzneimittel kein erhöhtes kardiales Risiko bei Männern, so das Ergebnis eines EU-weiten Reviews.
Nach den vorliegenden Untersuchungsergebnissen überwiegt der Nutzen von Testosteron nach wie vor die Risiken.
Diese PRAC-Empfehlung geht nun an die Coordination Group for Mutual Recoginition and Decentralised Procedures - human (CMDh), die endgültig darüber befinden wird.
Quelle:
Mitteilung der EMA vom 10. Oktober 2014
Nach den vorliegenden Untersuchungsergebnissen überwiegt der Nutzen von Testosteron nach wie vor die Risiken.
Diese PRAC-Empfehlung geht nun an die Coordination Group for Mutual Recoginition and Decentralised Procedures - human (CMDh), die endgültig darüber befinden wird.
Quelle:
Mitteilung der EMA vom 10. Oktober 2014
Vaproinsäure: PRAC empfiehlt Einschränkungen bei Mädchen und Frauen
Das Pharmacovigilance Risk Assessment Committee (PRAC) empfiehlt als Ergebnis seiner Oktobersitzung den Gebrauch von Valproinsäure bei Mädchen und Frauen im gebärfähigen Alter wegen des Risikos von Entwicklungsstörungen und Missbildungen einzuschränken.
Valproinsäure sollte nicht zur Behandlung von Epilepsien oder Bipolarstörungen bei Mädchen und Frauen, die schwanger oder im gebärfähigen Alter sind, eingesetzt werden, außer wenn andere Therapien nicht wirksam sind oder nicht vertragen werden. Dann muss jedoch eine wirksame Empfängnisverhütung und eine enge Überwachung erfolgen.
Diese PRAC-Empfehlung geht nun an die Coordination Group for Mutual Recoginition and Decentralised Procedures - human (CMDh), die endgültig darüber befinden wird.
Quelle:
Mitteilung der EMA vom 10. Oktober 2014
Valproinsäure sollte nicht zur Behandlung von Epilepsien oder Bipolarstörungen bei Mädchen und Frauen, die schwanger oder im gebärfähigen Alter sind, eingesetzt werden, außer wenn andere Therapien nicht wirksam sind oder nicht vertragen werden. Dann muss jedoch eine wirksame Empfängnisverhütung und eine enge Überwachung erfolgen.
Diese PRAC-Empfehlung geht nun an die Coordination Group for Mutual Recoginition and Decentralised Procedures - human (CMDh), die endgültig darüber befinden wird.
Quelle:
Mitteilung der EMA vom 10. Oktober 2014
Donnerstag, 9. Oktober 2014
Aceclofenac: Rote-Hand-Brief zu Warnhinweisen und KI
Der Hersteller weist in einem Rote-Hand-Brief darauf hin, dass die Therapie mit Aceclofenac ähnlich wie die mit Diclofenac und selektiven COX-2-Hemmern mit einem erhöhten Risiko arterieller thrombotischer Ereignisse assoziiert ist. Die systemische Anwendung von Diclofenac war kürzlich Gegenstand eines europaweiten Risikobewertungsverfahrens, in dem insbesondere die kardiovaskulären Risiken überprüft wurden. Als Ergebnis wurden für Diclofenac dieselben kardiovaskulären Vorsichtsmaßnahmen wie für selektive COX-2-Hemmer in die Produktinformation aufgenommen.
Aufgrund der strukturellen Ähnlichkeit von Aceclofenac zu Diclofenac und neuerer epidemiologischer Studien, die ein erhöhtes Risiko für nichttödliche akute Myocardinfarkte zeigen, wurden nun auch die Produkt- und die Fachinformation von Aceclofenac aktualisiert.
Aceclofenac ist jetzt kontraindiziert bei Patienten mit bekannter:
ischämischer Herzkrankheit
peripherer Gefäßkrankheit
zerebrovaskulärer Krankheit oder
kongestiver Herzinsuffizienz (NYHA II–IV)
Patienten mit diesen Erkrankungen sollten auf eine alternative Behandlung umgestellt werden.
Eine Behandlung mit Aceclofenac sollte nur nach sorgfältiger Abwägung eingeleitet werden bei Patienten mit:
kongestiver Herzinsuffizienz (NYHA I)
signifikanten Risikofaktoren für Herzkreislaufereignisse (z. B. Hypertonie, Hyperlidpidämie, Diabetes mellitus, Rauchen)
zerebrovaskulären Blutungen in der Vorgeschichte
Da sich die kardiovaskulären Risiken von Aceclofenac mit der Dosis und der Dauer der Anwendung erhöhen können, sollte die niedrigste wirksame tägliche Dosis über den kürzest möglichen Zeitraum angewendet werden. Es sollte regelmäßig überprüft werden, ob der Patient noch einer Symptomlinderung bedarf und wie er auf die Therapie anspricht.
Quelle:
AkDÄ Drug Safety Mail vom 9. Oktober 2014
Aufgrund der strukturellen Ähnlichkeit von Aceclofenac zu Diclofenac und neuerer epidemiologischer Studien, die ein erhöhtes Risiko für nichttödliche akute Myocardinfarkte zeigen, wurden nun auch die Produkt- und die Fachinformation von Aceclofenac aktualisiert.
Aceclofenac ist jetzt kontraindiziert bei Patienten mit bekannter:
ischämischer Herzkrankheit
peripherer Gefäßkrankheit
zerebrovaskulärer Krankheit oder
kongestiver Herzinsuffizienz (NYHA II–IV)
Patienten mit diesen Erkrankungen sollten auf eine alternative Behandlung umgestellt werden.
Eine Behandlung mit Aceclofenac sollte nur nach sorgfältiger Abwägung eingeleitet werden bei Patienten mit:
kongestiver Herzinsuffizienz (NYHA I)
signifikanten Risikofaktoren für Herzkreislaufereignisse (z. B. Hypertonie, Hyperlidpidämie, Diabetes mellitus, Rauchen)
zerebrovaskulären Blutungen in der Vorgeschichte
Da sich die kardiovaskulären Risiken von Aceclofenac mit der Dosis und der Dauer der Anwendung erhöhen können, sollte die niedrigste wirksame tägliche Dosis über den kürzest möglichen Zeitraum angewendet werden. Es sollte regelmäßig überprüft werden, ob der Patient noch einer Symptomlinderung bedarf und wie er auf die Therapie anspricht.
Quelle:
AkDÄ Drug Safety Mail vom 9. Oktober 2014
Menintitec: Rote-Hand-Brief wegen Qualitätsmängeln
Ein aktueller Rote-Hand-Brief informiert über einen Qualitätsmangel, der nach der Meldung einzelner
Produktbeanstandungen bei zwei deutschen Chargen festgestellt worden
ist. Die Injektionssuspension kann Eisenoxid- und/oder andere
Metallpartikel enthalten. Die Auslieferung von Meningitec® 10 Mikrogramm
wurde daraufhin gestoppt.
Großhändler, Apotheken, Krankenhäuser und Ärzte sollen sämtliche noch nicht verfallene Chargen aller Hersteller von Meningitec® 10 Mikrogramm retournieren (Kontaktdaten siehe Rote-Hand-Brief). Zurzeit ist nicht bekannt, wann Meningitec® wieder verfügbar sein wird. In Deutschland stehen zwei Alternativimpfstoffe gegen Meningokokken der Gruppe C zur Verfügung: Menjugate® und NeisVac-C.
Quelle:
AkDÄ Drug Safety Mail vom 9. Oktober 2014
Großhändler, Apotheken, Krankenhäuser und Ärzte sollen sämtliche noch nicht verfallene Chargen aller Hersteller von Meningitec® 10 Mikrogramm retournieren (Kontaktdaten siehe Rote-Hand-Brief). Zurzeit ist nicht bekannt, wann Meningitec® wieder verfügbar sein wird. In Deutschland stehen zwei Alternativimpfstoffe gegen Meningokokken der Gruppe C zur Verfügung: Menjugate® und NeisVac-C.
Quelle:
AkDÄ Drug Safety Mail vom 9. Oktober 2014
Montag, 29. September 2014
Agomelatin: PRAC-Empfehlungen zum Teil bestätigt
Der CHMP hat die Empfehlungen des Pharmacovigilance Risk Assessment Committee (PRAC) bestätigt, dass für Agomelatin (Valdoxan/Thmanax) weitere Maßnahmen zur Minimierung des Risikos von Leberschäden sinnvoll sind. So sollen die Leberfunktion vor Beginn der Behandlung und regelmäßig während der Behandlung untersucht werden.
Weil für Patienten über 75 Jahren keine Wirksamkeitsbelege vorliegen und diese Altersgruppe eine höheres Risiko schwerer Nebenwirkungen hat, empfahl das PRAC, dass der Einsatz von Agomelatin bei Patienten über 75 Jahre kontraindiziert sein soll. Dies sah der CHMP als nicht gerechtfertigt an.
Die CHMP-Meinung geht nun an die EU-Kommission, die eine legal verbindliche Entscheidung fällen wird.
Quelle:
Mitteilung der EMA vom 26. September 2014
Weil für Patienten über 75 Jahren keine Wirksamkeitsbelege vorliegen und diese Altersgruppe eine höheres Risiko schwerer Nebenwirkungen hat, empfahl das PRAC, dass der Einsatz von Agomelatin bei Patienten über 75 Jahre kontraindiziert sein soll. Dies sah der CHMP als nicht gerechtfertigt an.
Die CHMP-Meinung geht nun an die EU-Kommission, die eine legal verbindliche Entscheidung fällen wird.
Quelle:
Mitteilung der EMA vom 26. September 2014
Pasireotid: EMA empfiehlt Zulassungserweiterung
Der CHMP der EMA hat in seiner Sitzung vom September 2014 empfohlen, die Zulassung von Pasireotid (Signifor, Novartis) zu erweitern. Es soll nun auch für die Behandlung von Erwachsenen mit Akromegalie eingesetzt werden können, bei denen eine Chirurgie nicht angezeigt ist und die mit anderen Somatostatin-Analoga nicht ausreichend behandelt werden können.
Quelle:
Mitteilung der EMA vom 25. September 2014
Quelle:
Mitteilung der EMA vom 25. September 2014
Darunavir: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, die Zulassung von Darunavir (Prezista, Janssen-Cilag) so zu erweitern, dass es zusammen mit Cobicistat in Kombination mit anderen antiretroviralen Medikamenten für die Behandlung der HIV-Infektion bei Erwachsenen eingesetzt werden kann.
Bislang ist Darunavir zusammen mit niedrig dosiertem Ritonavir für die antivirale Kombinationstherapie zugelassen.
Außerdem wurde empfohlen, die Zulassung auf die Anwendung bei allen Kindern ab einem Alter von drei Jahren in geeigneten Dosierungen zu erweitern. Bislang konnte Darunavir nur bei ART-erfahrenen Kindern verwendet werden.
Quellen:
Mitteilung der EMA vom 25. September 2014
Mitteilung der EMA vom 25. September 2014
Bislang ist Darunavir zusammen mit niedrig dosiertem Ritonavir für die antivirale Kombinationstherapie zugelassen.
Außerdem wurde empfohlen, die Zulassung auf die Anwendung bei allen Kindern ab einem Alter von drei Jahren in geeigneten Dosierungen zu erweitern. Bislang konnte Darunavir nur bei ART-erfahrenen Kindern verwendet werden.
Quellen:
Mitteilung der EMA vom 25. September 2014
Mitteilung der EMA vom 25. September 2014
Ketoconazol: EMA empfiehlt erneute Zulassung bei Cushing-Syndrom
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, Ketoconazol für die Behandlung von Patienten mit Cushing-Syndrom zuzulassen.
Ketoconazol war lange für die Behandlung von Pilzinfektionen zugelassen. Im Juli 2013 wurde die Rücknahme der Zulassung für orale Darreichungsformen wegen Lebertoxizität empfohlen. Weil es bei Patienten mit Cushing-Syndrom nur wenige Therapiemöglichkeiten gibt, wurde es für diese Indikation nun von der EMA beschleunigt wieder zugelassen.
Quelle:
Pressemitteilung der EMA vom 26. September 2014
Ketoconazol war lange für die Behandlung von Pilzinfektionen zugelassen. Im Juli 2013 wurde die Rücknahme der Zulassung für orale Darreichungsformen wegen Lebertoxizität empfohlen. Weil es bei Patienten mit Cushing-Syndrom nur wenige Therapiemöglichkeiten gibt, wurde es für diese Indikation nun von der EMA beschleunigt wieder zugelassen.
Quelle:
Pressemitteilung der EMA vom 26. September 2014
Samstag, 27. September 2014
Naloxegol von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, Naloxegol (Moventig, AstraZeneca) für die Behandlung von erwachsenen Patienten mit Opioid-induzierte Obstipation zuzulassen, die nicht ausreichend auf Laxanzien ansprechen.
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Quelle:
Mitteilung der EMA vom 25. September 2014
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Die FDA hat Naloxegol im September 2014 zugelassen.
Quelle:
Mitteilung der EMA vom 25. September 2014
Balugrastim von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, den G-CSF Balugrastim (Egranli, Teva) für die Behandlung von Erwachsenen zur Reduktion von Dauer und Inzidenz einer Chemotherapie-induzierten Neutropenie zuzulassen
Quelle:
Mitteilung der EMA vom 25. September 2014
Quelle:
Mitteilung der EMA vom 25. September 2014
Nintedanib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, Nintedanib (Vargatef, Boehringer Ingelheim) in Kombination mit Docetaxel für die Therapie von erwachsenen Patienten mit lokal fortgeschrittenem, metastasiertem oder lokal rezidiviertem nicht kleinzelligen Bronchialkarzinom (NSCLC) mit Adenokarzinom-Histologie nach Erstlinientherapie zuzulassen.
Nintedanib ist ein Tyrosinkinase-Inhibitor, der VEGFR 1-3, PDGFR alpha und beta und FGFR1-3-kinasen-Aktivitäten hemmt, die für die Proliferation und das Überleben von Endothelzellen und perivaskulären Zellen wichtig sind.
Die Kombination aus Nintedanib und Docetaxel verlängerte bei Patienten mit NSCLC das PFS und das OS im Vergleich zu Docetaxel.
Häufigste Nebenwirkungen sind Neutropenie, verminderter Appetit, Elektrolytstörungen, periphere Neuropathie, Blutungen, Durchfall, Erbrechen, Übelkeit, erhöhte Alaninaminotransferase- und Aspartataminotransferaseaktivität, Mukositis, Hautausschlag.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 25. September 2014
Ramucirumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2014 empfohlen, Ramucirumab (Cyramza, Lilly) für die Behandlung von erwachsenen Patienten mit fortgeschrittenem Magenkarzinoms oder Adenokarzinom der gastroösopagealen Junktion zuzulassen, deren Erkrankung nach Chemotherapie mit Platinpräparaten und Fluorpyrimidin fortgeschritten ist. Ramucirumab soll in Kombination mit Paclitaxel eingesetzt werden. Bei Patienten, die für eine Behandlung mit Paclitaxel nicht geeignet sind, kann es auch in Monotherapie angewendet werden.
Ramucirumab ist ein humaner VEGF-Rezeptor-2-Antikörper, der die Angiogense durch Bindung von VEGF-A, VEGF-C und VEGF-D blockiert. Ramucirumab verlängert in Kombination mit Chemotherapie bzw. in Monotherapie das Gesamtüberleben im Vergleich zu alleiniger Chemotherapie bzw. Plazebo. Häufigste Nebenwirkungen sind Fatigue/Asthenie, Neutropenie, Leukopenie, Diarrhö, Epistaxis und Hypertonie.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 25. September 2014
Ramucirumab ist ein humaner VEGF-Rezeptor-2-Antikörper, der die Angiogense durch Bindung von VEGF-A, VEGF-C und VEGF-D blockiert. Ramucirumab verlängert in Kombination mit Chemotherapie bzw. in Monotherapie das Gesamtüberleben im Vergleich zu alleiniger Chemotherapie bzw. Plazebo. Häufigste Nebenwirkungen sind Fatigue/Asthenie, Neutropenie, Leukopenie, Diarrhö, Epistaxis und Hypertonie.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EMA vom 25. September 2014
Dienstag, 23. September 2014
Idelalisib von der EU-Kommission zugelassen
Idelalisib ist ein Inhibitor der Phosphatidylinositol-3-kinase p110δ (PI3Kδ), die bei B-Zell-Erkrankungen hyperaktiv ist. Sie spielt für verschiedene Signalwege eine wichtige Rolle, die an Proliferation, Überleben, Homing und Retention von malignen Zellen im Lymphgewebe und Knochenmark beteiligt sind.
Häufigste unerwünschte Wirkungen sind Infektionen, Neutropenie, erhöhte Transaminasen, erhöhte Triglyceride, Diarrhö/Kolitis, Hautausschlag und Fieber.
Als Teil der Zulassung muss ein Pharmakovigilanzprogramm implementiert werden.
Quelle:
Mitteilung der EU-Kommission
Sonntag, 21. September 2014
Dulaglutid von der FDA zugelassen
Die Food and Drug Administration (FDA) hat den GLP-1-Rezeptoragonist Dulaglutid (Trulicity, Lilly) zur subkutanen Injektion bei Patienten mit Diabetes mellitus Typ 2 zugelassen.
Wirksamkeit und Verträglichkeit von Dulaglutid wurden als Monotherapie und in Kombination mit anderen Antidiabetika in sechs klinischen Studien mit 3.342 Patienten untersucht. Der Blutzuckerspiegel und der HbA1c-Wert werden durch die Therapie gesenkt.
Dulaglutid soll nicht bei Patienten mit Diabetes mellitus Typ 1, bei Patienten mit diabetischer Ketoazidose, mit gastrointestinalen Problemen oder als Erstlinientherapie bei Patienten eingesetzt werden, die mit Diät und Bewegung nicht ausreichend behandelt werden können.
Die Produktinformation enthält einen Warnhinweis, weil bei Nagern unter Dulaglutid Schilddrüsentumoren aufgetreten waren. Es ist jedoch unklar, ob auch beim Menschen Tumoren induziert werden können. Dulaglutid sollte jedoch nicht bei Patienten mit einer familieren Belastung durch ein medulläres Schilddrüsenkarzinom mit bei Patienten mit multiplem endokrinem Neoplasie-Syndrom Typ 2 eingesetzt werden.
Der Hersteller hat von der FDA die Auflage erhalten, noch eine Reihe von Postmarketing-Studien durchzuführen. Die Substanz wurde mit einer Risk Evaluation und Mitigation Strategy (REMS) zugelassen.
Quelle:
Pressemitteilung der FDA vom 18. September 2014
Wirksamkeit und Verträglichkeit von Dulaglutid wurden als Monotherapie und in Kombination mit anderen Antidiabetika in sechs klinischen Studien mit 3.342 Patienten untersucht. Der Blutzuckerspiegel und der HbA1c-Wert werden durch die Therapie gesenkt.
Dulaglutid soll nicht bei Patienten mit Diabetes mellitus Typ 1, bei Patienten mit diabetischer Ketoazidose, mit gastrointestinalen Problemen oder als Erstlinientherapie bei Patienten eingesetzt werden, die mit Diät und Bewegung nicht ausreichend behandelt werden können.
Die Produktinformation enthält einen Warnhinweis, weil bei Nagern unter Dulaglutid Schilddrüsentumoren aufgetreten waren. Es ist jedoch unklar, ob auch beim Menschen Tumoren induziert werden können. Dulaglutid sollte jedoch nicht bei Patienten mit einer familieren Belastung durch ein medulläres Schilddrüsenkarzinom mit bei Patienten mit multiplem endokrinem Neoplasie-Syndrom Typ 2 eingesetzt werden.
Der Hersteller hat von der FDA die Auflage erhalten, noch eine Reihe von Postmarketing-Studien durchzuführen. Die Substanz wurde mit einer Risk Evaluation und Mitigation Strategy (REMS) zugelassen.
Quelle:
Pressemitteilung der FDA vom 18. September 2014
Naloxegol von der FDA zugelassen
Die Food and Drug Administration (FDA) hat Naloxegol (Movantik, AstraZeneca) zur Behandlung von Erwachsenen mit Opioid-induzierter Obstipation zugelassen, die unter chronischen, nicht durch Krebs verursachten Schmerzen leiden.
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Quelle:
Pressemitteilung der FDA vom 16. September 2014
Naloxegol ist eine pegylierte Form des Opiatantagonisten Naloxon. Die Pegylierung verzögert den Abbau und verhindert, dass Naloxon die Blut-Hirn-Schranke durchdringen kann. Deshalb antagonisiert Naloxegol die analgetische Wirkung der Opiate nicht.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit 1.352 Teilnehmern nachgewiesen. Sie hatten Opiate wegen nicht Krebs-bedingter Schmerzen über mindestens vier Wochen genommen und litten unter Obstipation. Im Vergleich zu Plazebo erhöhte sich durch Naloxegol die Zahl der wöchentlichen Stuhlgänge.
Häufige Nebenwirkungen waren abdominale Schmerzen, Durchfall, Kopfschmerzen und Blähungen.
Quelle:
Pressemitteilung der FDA vom 16. September 2014
Montag, 15. September 2014
Raltegravir als Granulat zugelassen
Die EU-Kommission hat den Integrasehemmer Raltegravir (Isentress, MSD Sharp & Dohme) als Granulat zugelassen. Es wird zur Herstellung einer Suspension für die Gabe an HIV-1-infizierte Säuglinge und Kleinkinder eingesetzt. Sie können mit Raltegravir ab einem Alter von vier Wochen in Kombination mit anderen antiretroviralen Medikamenten behandelt werden.
Die europäische Zulassung des Raltegravir-Granulats basiert auf 48-Wochen Daten zur Sicherheit, Verträglichkeit, Pharmakokinetik und Wirksamkeit der neuen pädiatrischen Darreichungsform. Diese wurden im Rahmen der multizentrischen, offenen Phase-I/II-Studie IMPAACT P1066 bei 26 HIV-1-infizierten, vorbehandelten Kindern im Alter von vier Wochen bis zwei Jahren erhoben.
Die europäische Zulassung des Raltegravir-Granulats basiert auf 48-Wochen Daten zur Sicherheit, Verträglichkeit, Pharmakokinetik und Wirksamkeit der neuen pädiatrischen Darreichungsform. Diese wurden im Rahmen der multizentrischen, offenen Phase-I/II-Studie IMPAACT P1066 bei 26 HIV-1-infizierten, vorbehandelten Kindern im Alter von vier Wochen bis zwei Jahren erhoben.
Freitag, 12. September 2014
Agomelatin: PRAC empfiehlt strengere Überwachung der Leberfunktion
Das Pharmacovigilance Risk Assessment Committee (PRAC) hat auf seiner Sitzung im September beschlossen, für Agomelatin (Valdoxan/Thmanax) weitere Maßnahmen zur Minimierung des Risikos von Leberschäden zu empfehlen. So sollen die Leberfunktion vor Beginn der Behandlung und regelmäßig während der Behandlung untersucht werden.
Weil für Patienten über 75 Jahren keine Wirksamkeitsbelege vorliegen und diese Altersgruppe eine höheres Risiko schwerer Nebenwirkungen hat, empfiehlt das PRAC, dass der Einsatz von Agomelatin bei Patienten über 75 Jahre kontraindiziert sein soll.
Die Fachöffentlichkeit soll über diese Änderungen in einem Brief informiert werden.
Die Empfehlungen des PRAC gegen nun an den Ausschuss für Humanarzneimittel (CHMP), der in seiner Sitzung Ende September über die zu ergreifenden Maßnahmen beschließen wird.
Quelle
Mitteilung der EMA vom 12. September 2014
Weil für Patienten über 75 Jahren keine Wirksamkeitsbelege vorliegen und diese Altersgruppe eine höheres Risiko schwerer Nebenwirkungen hat, empfiehlt das PRAC, dass der Einsatz von Agomelatin bei Patienten über 75 Jahre kontraindiziert sein soll.
Die Fachöffentlichkeit soll über diese Änderungen in einem Brief informiert werden.
Die Empfehlungen des PRAC gegen nun an den Ausschuss für Humanarzneimittel (CHMP), der in seiner Sitzung Ende September über die zu ergreifenden Maßnahmen beschließen wird.
Quelle
Mitteilung der EMA vom 12. September 2014
Montag, 8. September 2014
Tocilizumab: EU-Kommission erweitert Zulassung
Die EU-Kommission hat die Zulassung von Tocilizumab (Roactemra, Roche) erweitert. Es kann nun auch für die Behandlung der schweren, aktiven und progressiven rheumatoiden Arthritis bei Erwachsenen, die nicht mit Methotrexat vorbehandelt sind, eingesetzt werden können.
Damit kann der Interleukin-6-Blocker auch bei Patienten mit früher rheumatoider Arthritis eingesetzt werden.
Damit kann der Interleukin-6-Blocker auch bei Patienten mit früher rheumatoider Arthritis eingesetzt werden.
Pembrolizumab von der FDA beschleunigt zugelassen
Die Food and Drug Administration (FDA) hat den PD1-Blocker Pembrolizumab (Keytruda, MSD Sharp & Dohme) beschleunigt als Breakthrough-Therapie für die Behandlung von Patienten mit nicht resektablem oder metastasiertem Melanom und Progression nach Behandlung mit Ipilimumab oder einen BRAF-Hemmer zugelassen.
Pembrolizumab ist ein humanisierter Antikörper, der gegen PD-1 (Programmed Death) gerichtet ist. Er blockiert die Interaktion von PD-1 auf T-Zellen mit seinen Liganden PD-L1 und PD-L2. Hierdurch kann das körpereigene Abwehrsystem gegen Tumoren reaktiviert werden. Pembrolizumab wird derzeit bei mehr als 30 Krebsformen untersucht.
Die Zulassung basierte auf den Ergebnissen einer multizentrischen, offenen, randomisierten Kohorte in Studie P001. 173 Patienten mit nicht resektablem oder metastasiertem Melanom mit einer Krankheitsprogression innerhalb von 24 Wochen nach der letzten Dosis von Ipilimumab oder eines BRAF-Hemmers bei BRAF-V-600-Mutation erhielten randomisiert Pembrolizumab intravenös 2 mg/kg (n = 89) oder 10 mg/kg (n = 84) alle drei Wochen bis zur Progression der Erkrankung oder bis zur inakzeptablen Toxizität. Die objektive Ansprechrate betrug 24 % im 2-mg-Arm (1 CR, 20 PR). Ähnliche Raten wurden mit 10 mg/kg erzielt.
Als Auflage der FDA muss MSD Sharp & Dohme eine multizentrische, randomisierte Studie durchführen, in der die Überlegenheit von Pembrolizumab im Vergleich zur Standardtherapie nachgewiesen wird. Derzeit laufen zwei multizentrische randomisierte Studien bei Patienten mit nicht resektablem oder metastasiertem Melanom. In Studie P002 werden Ipilimumab-refraktäre Patienten und in Studie P006 Ipilimumab-naive Patienten behandelt. Primäre Endpunkte sind jeweils PFS und OS.
Quelle:
Mitteilung der FDA vom 4. September 2014
Pembrolizumab ist ein humanisierter Antikörper, der gegen PD-1 (Programmed Death) gerichtet ist. Er blockiert die Interaktion von PD-1 auf T-Zellen mit seinen Liganden PD-L1 und PD-L2. Hierdurch kann das körpereigene Abwehrsystem gegen Tumoren reaktiviert werden. Pembrolizumab wird derzeit bei mehr als 30 Krebsformen untersucht.
Die Zulassung basierte auf den Ergebnissen einer multizentrischen, offenen, randomisierten Kohorte in Studie P001. 173 Patienten mit nicht resektablem oder metastasiertem Melanom mit einer Krankheitsprogression innerhalb von 24 Wochen nach der letzten Dosis von Ipilimumab oder eines BRAF-Hemmers bei BRAF-V-600-Mutation erhielten randomisiert Pembrolizumab intravenös 2 mg/kg (n = 89) oder 10 mg/kg (n = 84) alle drei Wochen bis zur Progression der Erkrankung oder bis zur inakzeptablen Toxizität. Die objektive Ansprechrate betrug 24 % im 2-mg-Arm (1 CR, 20 PR). Ähnliche Raten wurden mit 10 mg/kg erzielt.
Als Auflage der FDA muss MSD Sharp & Dohme eine multizentrische, randomisierte Studie durchführen, in der die Überlegenheit von Pembrolizumab im Vergleich zur Standardtherapie nachgewiesen wird. Derzeit laufen zwei multizentrische randomisierte Studien bei Patienten mit nicht resektablem oder metastasiertem Melanom. In Studie P002 werden Ipilimumab-refraktäre Patienten und in Studie P006 Ipilimumab-naive Patienten behandelt. Primäre Endpunkte sind jeweils PFS und OS.
Quelle:
Mitteilung der FDA vom 4. September 2014
Abonnieren
Posts (Atom)