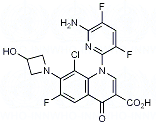
Die EU-Kommission hat am 16. Dezember 2019 Delafloxacin (Quofenix, Menarini) zur parenteralen und oralen Behandlung von akuten bakteriellen Infektionen der Haut und der Weichgewebe bei Erwachsenen zugelassen, wenn andere allgemein empfohlene Antibiotika nicht eingesetzt werden können.
Delafloxacin ist ein Fluorchinolon, es hemmt die bakterielle Topoisomerase IV und DNS-Gyrase (Topoisomerase II). Diese Enzyme werden für die bakterielle Replikation, Transkription, Reparatur und Rekombination der DNS benötigt. Es wirkt gegen grampositive und gramnegative Mikroorganismen, z. b. Staphylokokken, Streptokokken, Enterokokken, E. coli, Enterobacter, Klebsiellen, Proteus mirabilis und Pseudomonas aeruginosa.
Quelle
EPAR der EMA
Freitag, 20. Dezember 2019
Donnerstag, 19. Dezember 2019
Esketamin: Zulassung von der EU-Kommisison erweitert
Die EU-Kommission hat die Zulassung von Esketamin erweitert, es kann als Spravato in Kombination mit einem SSRI oder SNRI zur Behandlung von Erwachsenen mit therapieresistenter Major Depression eingesetzt werden können, die auf mindestens zwei unterschiedliche Antidepressiva bei der aktuellen Depressionsepisode nicht angesprochen haben. Spravato wird als Nasenspray appliziert.
Esketamin wird auch als Injektionsanästhetikum eingesetzt.
Quelle
EPAR der EMA
Esketamin wird auch als Injektionsanästhetikum eingesetzt.
Quelle
EPAR der EMA
Upadacitinib von der EU-Kommission zugelassen
Die EU-Kommission hat am 16. Dezember 2019 Upadacitinib (Rinvoq, Abbvie) für die orale Behandlung der mäßig schweren bis schweren aktiven rheumatoiden Arthritis bei Erwachsenen zugelassen, die nicht ausreichend auf eines oder mehrere DMARDs ansprechen oder diese nicht vertragen. Upadacitinib kann in Monotherapie oder in Kombination mit Methotrexat eingesetzt werden.
Upadacitinib ist ein selektiver und reversibler Januskinase(JAK)-Inhibitor. In humanzellbasierten Assays inhibiert Upadacitinib bevorzugt JAK1- oder JAK1/3-Signalwege im Vergleich zu anderen Zytokin-Signalwegen, die über JAK2-Paare vermittelt werden.
Wirksamkeit und Sicherheit von Upadacitinib 15 mg einmal täglich wurde in fünf randomisierten, doppelblinden, multizentrischen Phase-III-Studien (SELECT-Programm) bei Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die die ACR/EULAR-Klassifikationskriterien von 2010 erfüllten, untersucht.
Quelle
EPAR der EMA
Wirksamkeit und Sicherheit von Upadacitinib 15 mg einmal täglich wurde in fünf randomisierten, doppelblinden, multizentrischen Phase-III-Studien (SELECT-Programm) bei Patienten mit mittelschwerer bis schwerer aktiver rheumatoider Arthritis, die die ACR/EULAR-Klassifikationskriterien von 2010 erfüllten, untersucht.
Quelle
EPAR der EMA
Nasal applizierbares Glucagon von der EU-Kommission zugelassen
Die EU-Kommission hat am 16. Dezember 2019 nasal applizierbares Glucagon (Baqsimi, Lilly) zur Behandlung der schweren Hypoglykämie bei Erwachsenen und Kindern ab 4 Jahren zugelassen. Damit steht erstmals eine nicht injizierbare Glucagonzubereitung zur Verfügung.
Baqsimi enthält das Nasenpulver mit 3 mg Glucagon in Einzeldosisbehältnissen. Glucacon wird durch die Nasenschleimhaut passiv resorbiert.
Glucagon erhöht die Blutglucosekonzentration durch Aktivierung der Glucagon-Rezeptoren in der Leber, wodurch ein Glykogenabbau und eine Glucose-Freisetzung durch die Leber stimuliert wird. Hepatische Glykogenspeicher sind notwendig, damit Glucagon einen anti-hypoglykämischen Effekt erzielen kann.
Quelle
EPAR der EMA
Baqsimi enthält das Nasenpulver mit 3 mg Glucagon in Einzeldosisbehältnissen. Glucacon wird durch die Nasenschleimhaut passiv resorbiert.
Glucagon erhöht die Blutglucosekonzentration durch Aktivierung der Glucagon-Rezeptoren in der Leber, wodurch ein Glykogenabbau und eine Glucose-Freisetzung durch die Leber stimuliert wird. Hepatische Glykogenspeicher sind notwendig, damit Glucagon einen anti-hypoglykämischen Effekt erzielen kann.
Quelle
EPAR der EMA
Freitag, 13. Dezember 2019
Apalutamid, Bedaquilin, Daratumumab, Fidaxomicin, Fosnetupitant/Palonosetron, Ramucirumab, Tafamidis, Ustekinumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2019 empfohlen, die Zulassung von Apalutamid, Bedaquilin, Daratumumab, Fidaxomicin, Fosnetupitant/Palonosetron, Ramucirumab, Tafamidis, Ustekinumab zu erweitern.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
- Apalutamid (Erleada, Janssen) soll künftig bei Männern mit metastasiertem hormonsensitivem Prostatakarzinom in Kombination mit einer Androgendeprivation eingesetzt werden können.
- Bedaquilin (Sirturo, Janssen) soll künftig schon bei Patienten ab einem Alter von 12 Jahren und einem Körpergewicht von mindestens 30 kg eingesetzt werden können.
- Daratumumab (Darzalex, (Janssen) soll künftig in Kombination mit Bortezomib, Thalidomid und Dexamethason für die Behandlung von Erwachsenen mit neu diagnostiziertem multiplem Myelom eingesetzt werden können, die für eine Stammzelltransplantation vorgesehen sind.
- Fidaxomicin (Dificlir, Astellas) soll künftig als Filmtabletten schon bei Kindern ab einem Körpergewicht von 12,5 kg für die Behandlung von Clostridioides-difficile-Infektionen eingesetzt werden können.
- Fosnetupitant/Palonosetron (Akynzeo, Helsinn) soll künftig als Infusionslösung zu Verfügung stehen.
- Ramucirumab (Cyramza, Lilly) soll künftig in Kombination mit Erlotinib zur Erstlinientherapie von Erwachsenen mit metastasiertem NSCLC mit aktivierenden EGFR-Mutatoinen eingesetzt werden können.
- Tafamidis (Vyndaqel, Pfizer) soll künftig in Form von Weichkapseln mit 61 mg für die Behandlung von Wildtyp- oder erblicher Transthyretin-Amyloidose bei Erwachsenen mit Kardiomyopathie (ATTR-CM) eingesetzt werden können.
- Ustekinumab (Stelara, Janssen) soll künftig in der Behandlung der mäßig schweren bis schweren Plaquepsoriasis bei Kindern ab einem Alter von 6 Jahren eingesetzt werden können.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
Labels:
Apalutamid,
Bedaquilin,
Daratumumab,
Fidaxomicin,
Fosnetupitant/Palonosetron,
Ramucirumab,
Tafamidis,
Ustekinumab
Imipenem/Cilastatin/Relebactam von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2019 empfohlen, Imipenem/Cilastatin/Relebactam für die parenterale Behandlung von Erwachsenen mit Infektionen durch aerobe gramnegative Erreger mit begrenzten Therapiemöglichkeiten zuzulassen.
Relebactam ist ein neuer, intravenös verabreichter Inhibitor von Beta-Laktamasen der Klassen A und C, der nun in Kombination mit der seit langem in der Therapie eingesetzten Kombination aus dem Carbapenem Imipenem plus dem Dehydropeptidase-I-Inhibitor Cilastatin angewendet wird.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
Relebactam ist ein neuer, intravenös verabreichter Inhibitor von Beta-Laktamasen der Klassen A und C, der nun in Kombination mit der seit langem in der Therapie eingesetzten Kombination aus dem Carbapenem Imipenem plus dem Dehydropeptidase-I-Inhibitor Cilastatin angewendet wird.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
Brolucizumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Dezember 2019 empfohlen, Brolucizumab (Beovu, Novartis) für die Behandlung der feuchten altersbedingten Makuladegeneration (AMD) zuzulassen.
Broculizumab ist ein Angiogenesehemmer, der den vaskulären endothelialen Wachstumsfaktor A hemmt und so die Endothelzellproliferation unterdrückt, wodurch die pathologische Gefäßneubildung und die vaskuläre Permeabilität verringert werden.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
Broculizumab ist ein Angiogenesehemmer, der den vaskulären endothelialen Wachstumsfaktor A hemmt und so die Endothelzellproliferation unterdrückt, wodurch die pathologische Gefäßneubildung und die vaskuläre Permeabilität verringert werden.
Weil das Brolucizumab-Molekül als einzelkettiger
Antikörperfragment relativ klein ist, soll es besser in das Gewebe penetrieren
und höhere Konzentrationen als die bisher verwendeten Substanzen erreichen
können.
In den beiden Phase-III-Studien HAWK
und HARRIER mit über 1.800 Patienten war Brolucizumab in der Wirksamkeit
dem Aflibercept nicht unterlegen.
Quelle:
Mitteilung der EMA vom 12. Dezember 2019
Romosozumab von der EU-Kommission zugelassen
Die EU-Kommission hat am 9. Dezember 2019 Romosozumab (Evenity, UCB) für die parenterale Behandlung der manifesten Osteoporose bei postmenopausalen Frauen mit deutlich erhöhtem Frakturrisiko zugelassen.
Die empfohlene Dosis beträgt einmal monatlich 210 mg Romosozumab (als zwei subkutane Injektionen von je 105 mg) über einen Zeitraum von 12 Monaten. Die Patienten sollten vor und während der Behandlung ausreichend Kalzium und Vitamin D einnehmen.
Romosozumab ist ein humanisierter monoklonaler Antikörper, der Sclerostin bindet und hemmt. Aufgrund der Aktivierung von Saumzellen (bone lining cells), der gesteigerten Knochenmatrix-produktion durch Osteoblasten und der Rekrutierung von Osteoprogenitorzellen stärkt Romosuzumab den Knochenaufbau. Zusätzlich führt Romosozumab zu Veränderungen bei der Expression von Osteoklastenmediatoren, was den Knochenabbau hemmt.
Dieser duale Wirkungsmechanismus mit verstärktem Knochenaufbau und gehemmtem Knochenabbau führt zu einem raschen Anstieg der trabekulären und kortikalen Knochenmasse, einer Verbesserung der Knochenstruktur und der Festigkeit.
Wirksamkeit und Verträglichkeit wurden u.a. im Vergleich zu Alendronsäure (ARCH-Studie) und zu Placebo (FRAME) untersucht.
Quelle
EPAR der EMA
Die empfohlene Dosis beträgt einmal monatlich 210 mg Romosozumab (als zwei subkutane Injektionen von je 105 mg) über einen Zeitraum von 12 Monaten. Die Patienten sollten vor und während der Behandlung ausreichend Kalzium und Vitamin D einnehmen.
Romosozumab ist ein humanisierter monoklonaler Antikörper, der Sclerostin bindet und hemmt. Aufgrund der Aktivierung von Saumzellen (bone lining cells), der gesteigerten Knochenmatrix-produktion durch Osteoblasten und der Rekrutierung von Osteoprogenitorzellen stärkt Romosuzumab den Knochenaufbau. Zusätzlich führt Romosozumab zu Veränderungen bei der Expression von Osteoklastenmediatoren, was den Knochenabbau hemmt.
Dieser duale Wirkungsmechanismus mit verstärktem Knochenaufbau und gehemmtem Knochenabbau führt zu einem raschen Anstieg der trabekulären und kortikalen Knochenmasse, einer Verbesserung der Knochenstruktur und der Festigkeit.
Wirksamkeit und Verträglichkeit wurden u.a. im Vergleich zu Alendronsäure (ARCH-Studie) und zu Placebo (FRAME) untersucht.
Quelle
EPAR der EMA
Freitag, 6. Dezember 2019
Kongress-Splitter vom DIVI-Kongress in HH
Der Referent bemüht sich, die wichtigsten pharmakologischen Begriffe ganz einfach zu erklären:
Er sagt und schreibt auf seinem Chart:
Damit liegt er aber haarscharf daneben, denn es ist gerade umgekehrt:
Die Pharmakodynamik beschreibt das, was die Substanz im Körper bzw. mit einem Erreger macht, also die Wirkung, während die Pharmakokinetik das beschreibt, was der Körper mit der Substanz macht, wie er sie z. B. absorbiert, verteilt, verstoffwechselt und ausscheidet.
Auch mit den Einheiten bei Gewebekonzentrationen steht er etwas auf "Kriegsfuss", statt mg/l heißt es mg/ml.
Womit wieder einmal der Stellenwert der Pharmakologie im Klinik-Alltag demonstriert wird, obwohl sie doch so wichtig wäre.
Er sagt und schreibt auf seinem Chart:
Damit liegt er aber haarscharf daneben, denn es ist gerade umgekehrt:
Die Pharmakodynamik beschreibt das, was die Substanz im Körper bzw. mit einem Erreger macht, also die Wirkung, während die Pharmakokinetik das beschreibt, was der Körper mit der Substanz macht, wie er sie z. B. absorbiert, verteilt, verstoffwechselt und ausscheidet.
Auch mit den Einheiten bei Gewebekonzentrationen steht er etwas auf "Kriegsfuss", statt mg/l heißt es mg/ml.
Womit wieder einmal der Stellenwert der Pharmakologie im Klinik-Alltag demonstriert wird, obwohl sie doch so wichtig wäre.
Dienstag, 26. November 2019
Netarsudil von der EU-Kommission zugelassen
Die EU-Kommission hat am 19. November 2019 Netarsudil (Rhokiinsa, Aerie Pharmaceuticals) als Augentropfen für die Behandlung von erwachsenen Patienten mit primärem Offenwinkelglaukom oder okulärer Hypertension zur Reduzierung eines erhöhten Augeninnendrucks zugelassen.
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird. Vermutlich senkt es auch den episkleralen Venendruck. Nach topischer Gabe ins Auge wird Netarsudil zum aktiven Metaboliten AR-13503 biotransformiert.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle
EPAR der EMA
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird. Vermutlich senkt es auch den episkleralen Venendruck. Nach topischer Gabe ins Auge wird Netarsudil zum aktiven Metaboliten AR-13503 biotransformiert.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle
EPAR der EMA
Freitag, 15. November 2019
Tofacitinib: CHMP bestätigt PRAC-Empfehlungen wegen Blutgerinnungsstörungen
Eine Überprüfung von Tofacitinib (Xeljanz®) durch den Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) bei der EMA hatte ergeben, dass die Anwendung das Risiko von Blutgerinnseln in der Lunge und in tiefen Venen bei Patienten mit bereits vorhandenem hohen Risiko weiter verstärken könnte. Die hierzu vorgeschlagenen Empfehlungen des PRAC wurden nun vom Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) bestätigt.
Tofacitinib soll unabhängig von Dosis und Indikation bei Patienten mit hohem Blutgerinnungsrisiko mit Vorsicht angewendet werden. Darüber hinaus sollte die Erhaltungsdosis von 10 mg zweimal täglich nicht bei Risikopatienten mit Colitis ulcerosa verwendet werden, es sei denn, es fehlt eine geeignete alternative Behandlung. Patienten über 65 Jahre sollten nur dann mit Tofacitinib behandelt werden, wenn es keine andere geeignete Behandlung gibt.
Zu den Patienten mit hohem Risiko für die Bildung von Blutgerinnseln gehören Patienten mit Herzinsuffizienz, Myokardinfarkt, Krebs, angeborenen Blutgerinnungsstörungen oder einer Vorgeschichte von Blutgerinnseln sowie Patienten, die kombinierte hormonelle Verhütungsmittel einnehmen, eine Hormonersatztherapie erhalten, sich einer größeren Operation unterziehen oder immobilisiert sind.
Quelle
Mitteilung der EMA vom 14. November 2019
Tofacitinib soll unabhängig von Dosis und Indikation bei Patienten mit hohem Blutgerinnungsrisiko mit Vorsicht angewendet werden. Darüber hinaus sollte die Erhaltungsdosis von 10 mg zweimal täglich nicht bei Risikopatienten mit Colitis ulcerosa verwendet werden, es sei denn, es fehlt eine geeignete alternative Behandlung. Patienten über 65 Jahre sollten nur dann mit Tofacitinib behandelt werden, wenn es keine andere geeignete Behandlung gibt.
Zu den Patienten mit hohem Risiko für die Bildung von Blutgerinnseln gehören Patienten mit Herzinsuffizienz, Myokardinfarkt, Krebs, angeborenen Blutgerinnungsstörungen oder einer Vorgeschichte von Blutgerinnseln sowie Patienten, die kombinierte hormonelle Verhütungsmittel einnehmen, eine Hormonersatztherapie erhalten, sich einer größeren Operation unterziehen oder immobilisiert sind.
Quelle
Mitteilung der EMA vom 14. November 2019
Alemtuzumab: CHMP bestätigt PRAC-Empfehlungen
Nach Berichten über schwerwiegende Nebenwirkungen hat der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittel-Agentur (EMA) die Einschränkung der Anwendung von Alemtuzumab empfohlen, was nun vom Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) bestätigt wurde :
Quelle:
Mitteilung der EMA vom 15.11.2019
- Alemtuzumab soll nur noch angewendet werden bei Erwachsenen mit hochaktiver schubförmig-remittierend verlaufender Multipler Sklerose (MS) trotz angemessener Behandlung mit mindestens einer krankheitsmodifizierenden Therapie sowie bei Patienten mit rasch fortschreitender schubförmig verlaufender MS.
- Alemtuzumab soll nicht mehr angewendet werden bei Patienten mit bestimmten
- Herz-, Kreislauf- oder Blutungsstörungen sowie bei Patienten mit anderen Autoimmunerkrankungen als MS.
- Die Behandlung sollte in einem Krankenhaus mit raschem Zugang zu intensivmedizinischer Behandlung und mit Spezialisten im Umgang mit schwerwiegenden Nebenwirkungen erfolgen.
Quelle:
Mitteilung der EMA vom 15.11.2019
Lenalidomid und Trastuzumab Emtansin: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, die Zulassung von Lenalidomid und Trastuzumab Emtansin zu erweitern.
Quelle:
Mitteilung der EMA vom 14. November 2019
- Lenalidomid (Revlimid, Celgene) soll künftig in Kombination mit Rituximab für die Beandlung von Erwachsenen mit vorbehandeltem follikulärem Lymphom (Grad 1-3a) eingesetzt werden können.
- Trastuzumab Emtansin (Kadcyla, Roche) soll künftig für die adjuvante Monotherapie von Frauen mit HER2-positivem frühem Mammakarzinom und residueller invasiver Erkrankung nach präoperativer Taxan-basierter und gegen HER2 gerichteter Therapie.
Quelle:
Mitteilung der EMA vom 14. November 2019
Fostamatinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, Fostamatinib (Tavlesse, Rigel) für die orale Behandlung von Erwachsenen mit chronischer Immunthrombozytopenie (ITP) zuzulassen, die auf andere Behandlungen refraktär sind.
Quelle:
Mitteilung der EMA vom 14. November 2019
Fostamatinib ist ein Tyrosinkinase-Inhibitor, der in der Milz wirkt und die Signaltransduktion von B-Zell- und Fc-aktivierenden Rezeptoren hemmt. Es verringert die Antikörper-vermittelte Zerstörung von Thrombozyten.
Wirksamkeit und Verträglichkeit von Fostamatinib wurden in zwei multizentrischen randomisierten doppelblinden Studien (FIT1 und FIT2) bei 150 Patienten mit persistierender und chronischer IPT im Vergleich zu Plazebo nachgewiesen.Quelle:
Mitteilung der EMA vom 14. November 2019
Solriamfetol von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, Solriamfetol (Sunosi, Jazz Pharm) für die orale Behandlung von Erwachsenen mit Narkolepsie zuzulassen, um die Wachheit zu verbessern und die exzessive Tagesschläfrigkeit zu verringern. Zudem soll es bei Patienten mit obstruktiver Schlafapnoe (OSA) eingesetzt werden können, bei denen die exzessive Tagesschläfrigkeit nicht durch die primäre OSA-Therapie wie CPAP erfolgreich behandelt werden konnte.
Das Analeptikum Solriamfetol hemmt die Wiederaufnahme von Dopamin und Noradrenalin aus dem synaptischen Spalt.
Quelle:
Mitteilung der EMA vom 14. November 2019
Das Analeptikum Solriamfetol hemmt die Wiederaufnahme von Dopamin und Noradrenalin aus dem synaptischen Spalt.
Mitteilung der EMA vom 14. November 2019
Polatuzumab Vedotin von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, Polatuzumab Vedotin (Polivy, Roche) in Kombination mit Bendamustin und Rituximab bedingt für die parenterale Behandlung von erwachsenen Patienten mit rezidiviertem/refraktärer diffusem großen B-Zell-Lymphom zuzulassen, wenn sie keine Kandidaten für eine Stammzelltransplantation sind.
Polatuzumab Vedotin ist ein Antikörper-Konjugat, in dem der gegen CD79b gerichtete Antikörper Polatuzumuab mit dem Antimitotikum Monomethylauristatin E (MMAE) konjugiert ist. Nach Bindung an den CD79b-Rezeptor wird MMAE an die B-Zellen abgegeben und kann dort seine toxische Wirkung entfalten.
Quelle:
Mitteilung der EMA vom 14. November 2019
Polatuzumab Vedotin ist ein Antikörper-Konjugat, in dem der gegen CD79b gerichtete Antikörper Polatuzumuab mit dem Antimitotikum Monomethylauristatin E (MMAE) konjugiert ist. Nach Bindung an den CD79b-Rezeptor wird MMAE an die B-Zellen abgegeben und kann dort seine toxische Wirkung entfalten.
Quelle:
Mitteilung der EMA vom 14. November 2019
Siponimod von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, Siponimod (Mayzent, Novartis) für die orale Behandlung von erwachsenen Patienten mit sekundär progressiver multipler Sklerose (SPMS) zuzulassen.
Siponimod ist wie Fingolimod ein Sphingosin-1-phosphat-Rezeptormodulator, es bindet selektiv an zwei der fünf S1P-Rezeptoren, nämlich S1P1 und S1P5. Siponimod wirkt als funktioneller Antagonist an S1P1-Rezeptoren auf Lymphozyten und verhindert so deren Auswanderung aus den Lymphknoten. Dadurch wird die Rezirkulation von T-Zellen in das zentrale Nervensystem verringert und die zentrale Entzündung begrenzt.
Siponimod kann auch die Blut-Hirn-Schranke überwinden und an den S1P5-Rezeptor auf Oligodendrozyten und Astrozyten binden. Fingolimod bindet dagegen auch an S1P3-Rezeptoren am Herzen und hat deshalb vermutlich kardiologische unerwünschte Wirkungen. Diese sollen bei Siponimod aufgrund der spezifischen Wirkung nicht auftreten.
Wirksamkeit und Verträglichkeit von Siponimod bei der SPMS wurden in der randomisierten, doppelblinden, plazebokontrollierten Phase-III-Studie EXPAND nachgewiesen, die 2018 im Lancet publiziert worden ist.
Quelle:
Mitteilung der EMA vom 14. November 2019
Siponimod ist wie Fingolimod ein Sphingosin-1-phosphat-Rezeptormodulator, es bindet selektiv an zwei der fünf S1P-Rezeptoren, nämlich S1P1 und S1P5. Siponimod wirkt als funktioneller Antagonist an S1P1-Rezeptoren auf Lymphozyten und verhindert so deren Auswanderung aus den Lymphknoten. Dadurch wird die Rezirkulation von T-Zellen in das zentrale Nervensystem verringert und die zentrale Entzündung begrenzt.
Siponimod kann auch die Blut-Hirn-Schranke überwinden und an den S1P5-Rezeptor auf Oligodendrozyten und Astrozyten binden. Fingolimod bindet dagegen auch an S1P3-Rezeptoren am Herzen und hat deshalb vermutlich kardiologische unerwünschte Wirkungen. Diese sollen bei Siponimod aufgrund der spezifischen Wirkung nicht auftreten.
Wirksamkeit und Verträglichkeit von Siponimod bei der SPMS wurden in der randomisierten, doppelblinden, plazebokontrollierten Phase-III-Studie EXPAND nachgewiesen, die 2018 im Lancet publiziert worden ist.
Mitteilung der EMA vom 14. November 2019
Osilodrostat von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom November 2019 empfohlen, Osilodrostat (Isturisa, Novartis) für die orale Behandlung von erwachsenen Patienten endogenem Cushing-Syndrom zuzulassen.
Osilodrostat hemmt das Enzym 11-Beta-Hydroxylase, das für den letzten Schritt bei der Cortisol-Biosynthese zuständig ist. Es kann erhöhte Cortisol-Spiegel kontrollieren oder normalisieren.
Damit wirkt Osilodrostat ähnlich, wie der Steroid-11-Beta-Hydroxylasehemmer Metyrapon (Metopiron®, HRA Pharma), der vor allem zu diagnostischen Zwecken eingesetzt wird. Osilodrostat hat jedoch mit etwa 4 bis 5 Stunden eine längere Halbwertszeit, was eine zweimal tägliche Gabe ermöglicht. Zudem hemmt es die 11-Beta-Hydroxylase stärker.
Im Juli 2019 hat Recordati von Novartis die weltweiten Rechte an Osilodrostat und an dem Somatostatinanalogon Pasireotid (Signifor) gekauft, das ebenfalls zur Behandlung des Cushing-Syndroms eingesetzt wird.
Quellen:
Mitteilung der EMA vom 14. November 2019
Pressemitteilung Recordati vom Juli 2019
Osilodrostat hemmt das Enzym 11-Beta-Hydroxylase, das für den letzten Schritt bei der Cortisol-Biosynthese zuständig ist. Es kann erhöhte Cortisol-Spiegel kontrollieren oder normalisieren.
Damit wirkt Osilodrostat ähnlich, wie der Steroid-11-Beta-Hydroxylasehemmer Metyrapon (Metopiron®, HRA Pharma), der vor allem zu diagnostischen Zwecken eingesetzt wird. Osilodrostat hat jedoch mit etwa 4 bis 5 Stunden eine längere Halbwertszeit, was eine zweimal tägliche Gabe ermöglicht. Zudem hemmt es die 11-Beta-Hydroxylase stärker.
Im Juli 2019 hat Recordati von Novartis die weltweiten Rechte an Osilodrostat und an dem Somatostatinanalogon Pasireotid (Signifor) gekauft, das ebenfalls zur Behandlung des Cushing-Syndroms eingesetzt wird.
Mitteilung der EMA vom 14. November 2019
Pressemitteilung Recordati vom Juli 2019
Donnerstag, 14. November 2019
Ebola-Impfstoff von der EU-Kommission zugelassen
Die EU-Kommission hat am 11. November 2019 Impfstoff gegen Ebola, die Ebola Zaire Vakzine rVSVΔG-ZEBOV-GP, live (Ervebo, MSD) zugelassen.
Der Ebola Zaire-Impfstoff (rVSVΔG-ZEBOV-GP, lebend) ist indiziert für die aktive Immunisierung von Personen ab 18 Jahren zum Schutz vor der Ebola-Viruskrankheit (EVD [Ebola Virus Disease]), die durch das Zaire-Ebola-Virus verursacht wird.
Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Die Dauer des Impfschutzes ist nicht bekannt, daher sollen andere Ebola-Kontrollmaßnahmen nicht unterbrochen werden.
Der Ebola Zaire-Impfstoff (rVSVΔG-ZEBOV-GP, lebend) ist indiziert für die aktive Immunisierung von Personen ab 18 Jahren zum Schutz vor der Ebola-Viruskrankheit (EVD [Ebola Virus Disease]), die durch das Zaire-Ebola-Virus verursacht wird.
Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Die Dauer des Impfschutzes ist nicht bekannt, daher sollen andere Ebola-Kontrollmaßnahmen nicht unterbrochen werden.
Quellen
EPAR der EMA
EPAR der EMA
Montag, 4. November 2019
Alemtuzumab: PRAC empfiehlt Maßnahmen zur Minimierung schwerwiegender Nebenwirkungen
Nach Berichten über schwerwiegende Nebenwirkungen hat der Ausschuss für Risikobewertung im Bereich der Pharmakovigilanz (PRAC) der Europäischen Arzneimittel-Agentur (EMA) die Einschränkung der Anwendung von Alemtuzumab empfohlen:
Die neuen Empfehlungen des PRAC ersetzen die vorläufigen Maßnahmen vom April 2019 und basieren auf der Bewertung von Berichten über seltene, aber schwerwiegende und zum Teil tödliche Nebenwirkungen. Diese umfassen immunvermittelte Krankheiten mit einer möglicherweise monatelangen Latenz sowie schwere Herz- und Kreislauferkrankungen und Schlaganfall, die während oder innerhalb weniger Tage nach der Infusion von Alemtuzumab auftreten können.
Die Empfehlungen des PRAC werden nun dem Ausschuss für Humanarzneimittel der EMA weitergeleitet, der die endgültige Position der EMA verabschieden wird.
Quellen:
PRAC-Empfehlungen vom 31.10.2019
AkdÄ Drug Safety Mail vom 4.11.2019
- Alemtuzumab soll nur noch angewendet werden bei Erwachsenen mit hochaktiver schubförmig-remittierend verlaufender Multipler Sklerose (MS) trotz angemessener Behandlung mit mindestens einer krankheitsmodifizierenden Therapie sowie bei Patienten mit rasch fortschreitender schubförmig verlaufender MS.
- Alemtuzumab soll nicht mehr angewendet werden bei Patienten mit bestimmten
- Herz-, Kreislauf- oder Blutungsstörungen sowie bei Patienten mit anderen Autoimmunerkrankungen als MS.
- Die Behandlung sollte in einem Krankenhaus mit raschem Zugang zu intensivmedizinischer Behandlung und mit Spezialisten im Umgang mit schwerwiegenden Nebenwirkungen erfolgen.
Die neuen Empfehlungen des PRAC ersetzen die vorläufigen Maßnahmen vom April 2019 und basieren auf der Bewertung von Berichten über seltene, aber schwerwiegende und zum Teil tödliche Nebenwirkungen. Diese umfassen immunvermittelte Krankheiten mit einer möglicherweise monatelangen Latenz sowie schwere Herz- und Kreislauferkrankungen und Schlaganfall, die während oder innerhalb weniger Tage nach der Infusion von Alemtuzumab auftreten können.
Die Empfehlungen des PRAC werden nun dem Ausschuss für Humanarzneimittel der EMA weitergeleitet, der die endgültige Position der EMA verabschieden wird.
Quellen:
PRAC-Empfehlungen vom 31.10.2019
AkdÄ Drug Safety Mail vom 4.11.2019
Mittwoch, 30. Oktober 2019
Gilteritinib von der EU-Kommission zugelassen
Die EU-Kommission hat am 24. Oktober 2019 Gilteritinib (Xospata, Astellas) als Orphan Drug in Monotherapie für die orale Behandlung von Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML) mit einer FLT3-Mutation zugelassen.
Gilteritinibfumarat ist ein FLT3- und AXL-Inhibitor. Gilteritinib inhibiert die Signalwege des FLT3-Rezeptors und die Proliferation in den Zellen, die FLT3-Mutationen exogen exprimieren, einschließlich FLT3-ITD, FLT3-D835Y und FLT3-ITDD835Y, und es induziert eine Apoptose bei leukämischen Zellen, die FLT3-ITD exprimieren.
Wirksamkeit und Verträglichkeit wurden in der offenen, multizentrischen, randomisierten Phase-3-Studie Admiral untersucht, in der 371 Patienten mit r/r-AMLT und FLT3-Mutation eingeschlossen worden waren. Gilterinib verlängerte im Vergleich zu Chemotherapie das GEsamtüberleben von 5,6 auf 9,3 Monate.
Quelle
EPAR der EMA
Gilteritinibfumarat ist ein FLT3- und AXL-Inhibitor. Gilteritinib inhibiert die Signalwege des FLT3-Rezeptors und die Proliferation in den Zellen, die FLT3-Mutationen exogen exprimieren, einschließlich FLT3-ITD, FLT3-D835Y und FLT3-ITDD835Y, und es induziert eine Apoptose bei leukämischen Zellen, die FLT3-ITD exprimieren.
Wirksamkeit und Verträglichkeit wurden in der offenen, multizentrischen, randomisierten Phase-3-Studie Admiral untersucht, in der 371 Patienten mit r/r-AMLT und FLT3-Mutation eingeschlossen worden waren. Gilterinib verlängerte im Vergleich zu Chemotherapie das GEsamtüberleben von 5,6 auf 9,3 Monate.
Quelle
EPAR der EMA
Dienstag, 22. Oktober 2019
Daratumumab, Esketamin, Insulin glargin, Ivacaftor, Pembrolizumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, die Zulassung von Daratumumab, Esketamin, Insulin glargin, Ivacaftor, Pembrolizumab zu erweitern.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
- Daratumumab (Darzalex, Janssen) soll künftig auch in Kombination mit Lenalidomid und Dexamethason bei Erwachsenen mit neu diagnostiziertem multiplem Myelom eingesetzt werden können, für die eine Stammzelltransplantation nicht in Frage kommt.
- Esketamin soll als Spravato in Kombination mit einem SSRI oder SNRI zur Behandlung von Erwachsenen mit therapieresistenter Major Depression eingesetzt werden können, die auf mindestens zwei unterschiedliche Antidepressiva bei der aktuellen Depressionsepisode nicht angesprochen haben. Spravato wird als Nasenspray appliziert.
- Insulin glargin (Toujeo, Sanofi Aventis) soll künftig bei Jugendlichen und Kindern ab einem Alter von 6 Jahren eingesetzt werden können.
- Ivacaftor (Kalydeco, Vertex) soll künftig schon bei Kindern ab 6 Monaten und Babies ab 5 kg mit zystischer Fibrose eingesetzt werden können.
- Pembrolizumab (Keytruda, MSD) soll künftig in Monotherapie oder in Kombination mit Platin-haltiger Chemotherapie und 5-Fluorouracil für die Erstlinienbehandlung von metastasierten oder nichtresezierbaren rezidivierten Kopf-Hals-Tumoren mit Plattenepithelhistologie bei Erwachsenen eingesetzt werden können, wenn die Tumoren PD-L1 mit einer CPS ≥ 1 exprimieren.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Romosozumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Romosozumab (Evenity, UCB) für die parenterale Behandlung der schweren Osteoporose bei postmenopausalen Frauen mit hohem Frakturrisiko zuzulassen.
Romosozumab ist ein monoklonaler Antikörper, der Sclerostin hemmt. Sclerostin spielt eine wichtige Rolle beim Knochenauf- und -abbau. Durch Hemmung von Sclerostin wird die Knochenneubildung verstärkt und der Knochenabbau gehemmt.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Romosozumab ist ein monoklonaler Antikörper, der Sclerostin hemmt. Sclerostin spielt eine wichtige Rolle beim Knochenauf- und -abbau. Durch Hemmung von Sclerostin wird die Knochenneubildung verstärkt und der Knochenabbau gehemmt.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Upadacitinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Upadacitinib (Rinvoq, Abbvie) für die orale Behandlung der mäßig schweren bis schweren aktiven rheumatoiden Arthritis bei Erwachsenen zuzulassen, die nicht ausreichend auf eines oder mehrere DMARDs ansprechen oder diese nicht vertragen. Upadacitinib kann in Monotherapie oder in Kombination mit Methotrexat eingesetzt werden.
Upadacitinib ist ein selektiver Hemmer der Januskinasen 1 oder 1/3 (JAK).
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Upadacitinib ist ein selektiver Hemmer der Januskinasen 1 oder 1/3 (JAK).
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Delafloxacin von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Delafloxacin (Quofenix, Menarini) zur parenteralen und oralen Behandlung von akuten bakteriellen Infektionen der Haut und der Weichgewebe bei Erwachsenen zuzulassen, wenn andere allgemein empfohlene Antibiotika nicht eingesetzt werden können.
Delafloxacin ist ein Fluorchinolonderivat, das auch bei schwierig zu behandelnden Erregern wie MRSA und multiresistenten gramnegativen Bakterien wirkt. Bei parenteraler Gabe wirkte Delafloxacin vergleichbar gut wie Vancomycin plus Aztreonam.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Delafloxacin ist ein Fluorchinolonderivat, das auch bei schwierig zu behandelnden Erregern wie MRSA und multiresistenten gramnegativen Bakterien wirkt. Bei parenteraler Gabe wirkte Delafloxacin vergleichbar gut wie Vancomycin plus Aztreonam.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Nasal applizierbares Glucagon von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, nasal applizierbares Glucagon (Baqsimi, Lilly) zur Behandlung der schweren Hypoglykämie zuzulassen. Damit steht erstmals eine nicht injizierbare Glucagonzubereitung zur Verfügung.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Ebolaimpfstoff von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, erstmals bedingt einen Impfstoff gegen Ebola, die Ebola Zaire Vakzine rVSVΔG-ZEBOV-GP, live (Ervebo) zuzulassen.
Der Impfstoff soll für die aktive Immunisierung von Personen ab 18 Jahren eingesetzt werden, die ein Risiko für eine Infektion mit dem Ebola-Virus haben. Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Der Impfstoff soll für die aktive Immunisierung von Personen ab 18 Jahren eingesetzt werden, die ein Risiko für eine Infektion mit dem Ebola-Virus haben. Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Dienstag, 8. Oktober 2019
Avelumab, Belimumab, Docetaxel, Dupilumab, Ranibizumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, die Zulassung von Avelumab, Belimumab, Docetaxel, Dupilumab, Ranibizumab zu erweitern.
Quelle:
Mitteilung der EMA vom 20. September 2019
- Avelumab (Bavencio, Merck) soll in Kombination mit Axitinib in der Erstlinientherapie von Erwachsenen mit fortgeschrittenem Nierenzellkarzinom eingesetzt werden können.
- Belimumab (Benlysta, GSK) soll künftig bei Kindern ab einem Alter von 5 Jahren eingesetzt werden können.
- Docetaxel (z. B. Taxotere, Sanofi) soll in Kombination mit ADT mit oder ohne Prednison bzw. Prednisolon bei Patienten mit metastasiertem hormonsensiblen Prostatakarzinom eingesetzt werden können.
- Dupilumab (Dupixent, Sanofi) soll als Add-on-Therapie zu nasalen Glucocorticoiden bei Erwachsenen mit schwerer chronischer Rhinosinusitis mit nasaler Polyposis eingesetz werden können, bei denen systemische Glucocorticoide oder/und eine Operatoin keine adäquate Krankheitskontrolle ermöglichen.
- Ranibizumab (Lucentis, Novartis) soll für die Behandlung der proliferativen diabetischen Retinopathie eingesetzt werden können.
Quelle:
Mitteilung der EMA vom 20. September 2019
Gilteritinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, Gilteritinib (Xospata, Astellas)in Monotherapie für die orale Behandlung von Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML) mit einer FLT3-Mutation zuzulassen.
Gilteritinib ist ein Proteinkinase-Inhibitor, der das FLT3-Rezeptor-Signalling hemmt und nachfolgend in leukämischen Zellen, die FLT3-ITD exprimieren zur Apoptose führt.
Quelle:
Mitteilung der EMA vom 20. September 2019
Gilteritinib ist ein Proteinkinase-Inhibitor, der das FLT3-Rezeptor-Signalling hemmt und nachfolgend in leukämischen Zellen, die FLT3-ITD exprimieren zur Apoptose führt.
Quelle:
Mitteilung der EMA vom 20. September 2019
Netarsudil von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, Netarsudil (Rhokiinsa, Aerie Pharmaceuticals) als Augentropfen für die Behandlung von Patienten mit Glaukom oder okularer Hypertension zuzulassen.
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle:
Mitteilung der EMA vom 20. September 2019
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle:
Mitteilung der EMA vom 20. September 2019
Ibalizumab von der EU-Kommission zugelassen
Die EU-Kommission hat am 26. September 2019 Ibalizumab (Trogarzo, Theratechnologies International Ltd.) in Kombination mit anderen antiretroviralen Substanzen zur parenteralen Behandlung von Erwachsenen mit multiresistenter HIV-Infektion zugelassen, für die kein anderes antivirales Regime verfügbar ist.
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle
EPAR der EMA
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle
EPAR der EMA
Montag, 23. September 2019
Larotrectinib von der EU-Kommission zugelassen
Die EU-Kommission hat am 19. September 2019 Larotrectinib (Vitrakvi, Bayer AG) für die orale Behandlung von Erwachsenen und Kindern mit soliden Tumoren zugelassen, die eine NTRK-Genfusion (neurotrophe Tyrosin-Rezeptor-Kinase) aufweisen und deren Tumoren lokal fortgeschrittenen oder metastasiert sind oder die chirurgisch nicht entfernt werden können und für deren Behandlung keine zufriedenstellenden Therapieoptionen zur Verfügung stehen. Larotrectinib ist damit das erste Medikament in der EU mit einer tumorunabhängigen Indikation.
Larotrectinib ist ein Adenosintriphosphat (ATP)-kompetitiver und selektiver Tropomyosin-RezeptorKinase(TRK)-Inhibitor, der entwickelt wurde, um eine Wirkung auf Off-Target-Kinasen zu
vermeiden. Ziel von Larotrectinib sind die Proteine der TRK-Familie, die TRKA, TRKB und
TRKC beinhalten und durch die Gene NTRK1, NTRK2 bzw. NTRK3 kodiert werden.
Obwohl TRK-Fusionstumoren insgesamt selten sind – basierend auf epidemiologischen Daten aus verschiedenen Ländern schätzt man die Gesamtzahl auf nicht mehr als einige Tausend Fälle in ganz Europa pro Jahr – können sowohl Kinder als auch Erwachsene davon betroffen sein. TRK-Fusionstumoren können überall im Körper auftreten, da die zugrunde liegenden NTRK-Genfusionen unabhängig von bestimmten Zell- oder Gewebearten auftreten können. In klinischen Studien wurde Larotrectinib in 29 verschiedenen Histologien untersucht. Der TRK-Hemmer Larotrectinib zeigte Wirksamkeit bei Patienten mit TRK-Fusionstumoren unabhängig von Tumortyp und Alter, auch bei Patienten mit Hirnmetastasen oder primären ZNS-Tumoren.
Quelle
Pressemitteilung der Firma Bayer vom 23.9.2019
Mittwoch, 21. August 2019
Upadacitinib von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 16. August 2019 Upadacitinib (Rinvoq, Abbvie) für die orale Behandlung von Erwachsenen mit moderater bis schwerer rheumatoider Arthritis zugelassen, bei denen Methotrexat nicht ausreichend wirkt oder die Methotrexat nicht vertragen.
Upadacitinib ist ein einmal täglich einnehmbarer JAK-Inhibitor, wobei JAK1 stärker gehemmt wird als JAK2, JAK3 und TYK2.
Quelle:
Prescribing information Rinvoq
Upadacitinib ist ein einmal täglich einnehmbarer JAK-Inhibitor, wobei JAK1 stärker gehemmt wird als JAK2, JAK3 und TYK2.
Quelle:
Prescribing information Rinvoq
Dienstag, 20. August 2019
Fedratinib von der FDA zugelassen
Die FDA hat am 16. August 2019 Fedratinib (Inrebic, Celgene) als Orphan Drug und beschleunigt für die orale Behandlung von primärer oder sekundärer Myelofibrose mit mittlerem oder hohem Risiko zugelassen.
Fedratinib ist ein selektiver, oraler Kinaseinhibitor, der mutationsaktivierte Janus-assoziierte-Kinasen-2 (JAK2) und FMS-ähnliche Tyrosinkinasen 3 (FLT3) hemmt.
Damit gibt es nach Ruxolitinib (Jakavi) eine weitere Therapieoption bei dieser Erkrankung.
Quelle
Pressemitteilung der FDA vom 16. August 2019
Fedratinib ist ein selektiver, oraler Kinaseinhibitor, der mutationsaktivierte Janus-assoziierte-Kinasen-2 (JAK2) und FMS-ähnliche Tyrosinkinasen 3 (FLT3) hemmt.
Damit gibt es nach Ruxolitinib (Jakavi) eine weitere Therapieoption bei dieser Erkrankung.
Quelle
Pressemitteilung der FDA vom 16. August 2019
Lefamulin von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 19. August 2019 Lefamulin (Xenleta, Nabriva Ther.) zur oralen oder intravenösen Behandlung von Erwachsenen mit ambulant erworbener Pneumonie zugelassen.
Lefamulin ist ein Pleuromutilin-Antibiotikum. Pleuromutiline wurden zwar schon in den 1950er Jahren entwickelt, Lefamulin ist jedoch das erste, das zur systemischen Anwendung zugelassen ist. Es hemmt die Proteinsynthese, in dem es an das Peptidyltransferase-Zentrum der 50S-Ribosomen bindet und so die Bindung von Transfer-RNA für den Peptidtransfer verhindert.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit über 1.200 Patienten im Vergleich zu Moxifloxacin ohne oder mit Linezolid nachgewiesen. Mit Lefamulin konnte eine ähnliche klinische Heilungrate wie mit den Vergleichssubstanzen erreicht werden.
Häufigste unerwünschte Wirkungen waren Durchfall, Übelkeit, Reaktionen an der Infusionsstelle, erhöhte Leberenzyme und Erbrechen. Das QT-Intervall im EKG kann verlängert werden.
Quelle:
Pressemitteilung der FDA vom 19. August 2019
Lefamulin ist ein Pleuromutilin-Antibiotikum. Pleuromutiline wurden zwar schon in den 1950er Jahren entwickelt, Lefamulin ist jedoch das erste, das zur systemischen Anwendung zugelassen ist. Es hemmt die Proteinsynthese, in dem es an das Peptidyltransferase-Zentrum der 50S-Ribosomen bindet und so die Bindung von Transfer-RNA für den Peptidtransfer verhindert.
Wirksamkeit und Verträglichkeit wurden in zwei Phase-III-Studien mit über 1.200 Patienten im Vergleich zu Moxifloxacin ohne oder mit Linezolid nachgewiesen. Mit Lefamulin konnte eine ähnliche klinische Heilungrate wie mit den Vergleichssubstanzen erreicht werden.
Häufigste unerwünschte Wirkungen waren Durchfall, Übelkeit, Reaktionen an der Infusionsstelle, erhöhte Leberenzyme und Erbrechen. Das QT-Intervall im EKG kann verlängert werden.
Quelle:
Pressemitteilung der FDA vom 19. August 2019
Freitag, 16. August 2019
Entrectinib von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 15. August 2019 Entrectinib (Rozlytrek, Genentech/Roche) für die orale Behandlung von Patienten ab 12 Jahren mit soliden Tumoren mit NTRK-Fusionen beschleunigt zugelassen. Das ist damit nach Pembrolizumab und Larotrectinib die dritte Substanz, die eine Biomarker-spezifische Zulassung für verschiedene Tumorarten erhält.
Außerdem wurde Entrectinib für die Behandlung von Erwachsenen mit ROS1-positivem NSCLC zugelassen.
Entrectinib ist ein selektiver Tyrosinkinase-Inhibitor, der die Kinase-Aktivität von TRK A/B/C- und ROS1-Proteinen hemmen kann.
Quelle
Pressemitteilung der FDA vom 15. August 2019
Außerdem wurde Entrectinib für die Behandlung von Erwachsenen mit ROS1-positivem NSCLC zugelassen.
Entrectinib ist ein selektiver Tyrosinkinase-Inhibitor, der die Kinase-Aktivität von TRK A/B/C- und ROS1-Proteinen hemmen kann.
Quelle
Pressemitteilung der FDA vom 15. August 2019
Pretomanid von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 14. August 2019 Pretomanid Tabletten in Kombination mit Bedaquilin und Linezolid für die Behandlung von erwachsenen Patienten mit extrem resistenter Tb (XDR-Tb) oder für Patienten mit multiresistenter Tb (MDR-Tb) zugelassen, die eine andere Therapie nicht vertragen oder nicht darauf ansprechen. Eine MDR-Tb liegt dann vor, wenn die Erreger resistent gegen die Standard-Tuberkulosemittel Isoniazid und Rifampicin sind, eine XDR-Tb, wenn sie zusätzlich resistent gegen mindestens zwei Zweitlinien-Medikamente sind.
Die Zulassung wurde der der Non-Profit-Organisation TB Alliance erteilt.
Pretomanid ist ein Nitroimidazol-Derivat.
Quelle:
Pressemitteilung der FDA vom 14. August 2019
Die Zulassung wurde der der Non-Profit-Organisation TB Alliance erteilt.
Pretomanid ist ein Nitroimidazol-Derivat.
Quelle:
Pressemitteilung der FDA vom 14. August 2019
Montag, 5. August 2019
Darolutamid von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 30. Juli 2019 Darolutamid (Nubeqa, Bayer) zur oralen Behandlung von Patienten mit nicht metastasiertem kastrationsresistentem Prostatakarzinom zugelassen.
Darolutamid ist wie Enzalutamid oder Apalutamid ein Androgenrezeptor-Antagonist. Wirksamkeit und Verträglichkeit wurden in der Phase-III-Studie ARAMIS (Androgen Receptor inhibiting Agent for MetastatIc-free Survival) an mehr als 1500 Patienten mit nicht metastasiertem kastrationsresistentem Prostatakrebs (nmCRPC) nachgewiesen.
Quelle:
Mitteilung der FDA vom 31. Juli 2019
Darolutamid ist wie Enzalutamid oder Apalutamid ein Androgenrezeptor-Antagonist. Wirksamkeit und Verträglichkeit wurden in der Phase-III-Studie ARAMIS (Androgen Receptor inhibiting Agent for MetastatIc-free Survival) an mehr als 1500 Patienten mit nicht metastasiertem kastrationsresistentem Prostatakrebs (nmCRPC) nachgewiesen.
Quelle:
Mitteilung der FDA vom 31. Juli 2019
Samstag, 3. August 2019
Pexidartinib von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 2. August 2019 Pexidartinib (Turalio, Daiichi Sankyo) als Breakthrough Therapy und Orphan Drug für die orale Behandlung von Patienten mit symptomatischem tenosynovialem Riesenzelltumor (TGCT) zugelassen, der mit starker Morbidität und Funktionseinschränkungen einhergeht und operativ nicht behandelt werden kann.
Der Tyrosinkinase-Inhibitor Pexidartinib hemmt den Kolonie-stimulierenden Faktor 1 Rezeptor (CSF1R) und wirkt antineoplastisch, immunmodulierend und als Makrophagen-Checkpoint-Inhibitor.
Pexidartinib bindet an CSF1R auf Monozyten, Makrophagen und Osteoklasten und hemmt die Bindung der CSF1R-Liganden CSF-1 und IL-34 an den Rezeptor. Hierdurch wird dessen Aktivierung über das Rezeptor vermittelte Signaling in die Zelle gehemmt.
Quelle
Pressemitteilung der FDA vom 2. August 2019
Der Tyrosinkinase-Inhibitor Pexidartinib hemmt den Kolonie-stimulierenden Faktor 1 Rezeptor (CSF1R) und wirkt antineoplastisch, immunmodulierend und als Makrophagen-Checkpoint-Inhibitor.
Pexidartinib bindet an CSF1R auf Monozyten, Makrophagen und Osteoklasten und hemmt die Bindung der CSF1R-Liganden CSF-1 und IL-34 an den Rezeptor. Hierdurch wird dessen Aktivierung über das Rezeptor vermittelte Signaling in die Zelle gehemmt.
Quelle
Pressemitteilung der FDA vom 2. August 2019
Donnerstag, 1. August 2019
Glucacon zur nasalen Applikation von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 24. Juli 2019 Glucagon als Pulver zur nasalen Applikation (Baqsimi, Eli Lilly) zur Behandlung von hypoglykämischen Episoden zugelassen.
Das Pulver wird in einem Einmaldispenser angeboten. Wirksamkeit und Verträglichkeit zur Behandlung der schweren Hypoglykämie wurden in zwei Stdien mit 83 und 70 erwachsenen Diabetikern sowie 48 Kindern ab 4 Jahren im Vergleich zu einer Einmalgabe von parenteral verabreichtem Glucacon untersucht. Nasal appliziertes Glucagon erhöhte die Blutzuckerspiegel vergleichbar gut wie parenteral appliziertes Glucagon.
Quelle:
Pressemitteilung der FDA vom 24. Juli 2019
Das Pulver wird in einem Einmaldispenser angeboten. Wirksamkeit und Verträglichkeit zur Behandlung der schweren Hypoglykämie wurden in zwei Stdien mit 83 und 70 erwachsenen Diabetikern sowie 48 Kindern ab 4 Jahren im Vergleich zu einer Einmalgabe von parenteral verabreichtem Glucacon untersucht. Nasal appliziertes Glucagon erhöhte die Blutzuckerspiegel vergleichbar gut wie parenteral appliziertes Glucagon.
Quelle:
Pressemitteilung der FDA vom 24. Juli 2019
Trientindihydrochlorid von der EU-Kommission zugelassen
Die EU-Kommission hat am 25. Juli 2019 Trientindihydrochlorid (Cufence, Univar BV) für die orale Behandlung der Wilson-Krankheit bei Jugendlichen, Erwachsenen und Kindern ab einem Alter von 5 Jahren zugelassen, die D-Penicillamin nicht vertragen.
Trientindihydrochlorid entzieht dem Körper Kupfer, in dem es einen einen stabilen Kupfer-Chelat-Komplex bildet, der mit dem Urin ausgeschieden wird. Trientin ist ein Chelatbildner mit einer polyaminartigen Struktur. Kupfer wird durch Bildung eines stabilen Komplexes cheliert, wobei sich die vier konstituierenden Stickstoffe in einem planaren Ring befinden. Somit ist die pharmakodynamische Wirkung von Trientin abhängig von der chemischen Eigenschaft des chelatbildenden Kupfers und nicht von seiner Wechselwirkung mit Rezeptoren, Enzymsystemen oder anderen biologischen Systemen, die je nach Spezies variieren. Trientin kann auch Kupfer im Magen-Darm-Trakt binden und somit die Kupferresorption hemmen.
Bereits im September 2017 hatte die EMA Trientintetrahydrochlorid (Cuprior, gmp-orphan) für die gleiche Indikation zugelassen
EPAR der EMA
Trientindihydrochlorid entzieht dem Körper Kupfer, in dem es einen einen stabilen Kupfer-Chelat-Komplex bildet, der mit dem Urin ausgeschieden wird. Trientin ist ein Chelatbildner mit einer polyaminartigen Struktur. Kupfer wird durch Bildung eines stabilen Komplexes cheliert, wobei sich die vier konstituierenden Stickstoffe in einem planaren Ring befinden. Somit ist die pharmakodynamische Wirkung von Trientin abhängig von der chemischen Eigenschaft des chelatbildenden Kupfers und nicht von seiner Wechselwirkung mit Rezeptoren, Enzymsystemen oder anderen biologischen Systemen, die je nach Spezies variieren. Trientin kann auch Kupfer im Magen-Darm-Trakt binden und somit die Kupferresorption hemmen.
Bereits im September 2017 hatte die EMA Trientintetrahydrochlorid (Cuprior, gmp-orphan) für die gleiche Indikation zugelassen
EPAR der EMA
Arginin/Lysin von der EU-Kommission zugelassen
Die EU-Kommission hat am 25. Juli 2019 Arginin/Lysin (LysaKare, Advanced Accelerator Applications) zur Verminderung der Strahlenbelastung im Rahmen einer Peptid-Rezeptor-Radionuklid-Therapie (PRRT) mit Lutetium(177Lu)-Oxodotreotid bei Erwachsenen zugelassen.
Die Infusionslösung enthält die Aminosäuren L-Arginin-HCl und L-Lysin-HCl.
Arginin und Lysin unterliegen der glomerulären Filtration und interferieren kompetitiv mit der Resorption von Lutetium (177Lu)-Oxodotreotid in der Niere und verringern damit die in den Nieren abgegebene Strahlendosis.
Quelle
EPAR der EMA
Die Infusionslösung enthält die Aminosäuren L-Arginin-HCl und L-Lysin-HCl.
Arginin und Lysin unterliegen der glomerulären Filtration und interferieren kompetitiv mit der Resorption von Lutetium (177Lu)-Oxodotreotid in der Niere und verringern damit die in den Nieren abgegebene Strahlendosis.
Quelle
EPAR der EMA
Montag, 29. Juli 2019
Änderung von Fach- und Gebrauchsinformationen wegen neuer Risikosignale
Das Pharmacovigilance Risk Assessment Committee (PRAC) der Europäischen Zulassungsbehörde (EMA) hat eine Änderung des Wortlauts in den Produktinformationen verschiedener Arzneimittel wegen bekannt gewordenen unerwünschten Ereignissen (Risikosignalen) empfohlen:
Quelle
AkdÄ Drug Safety Mail Nr. 43/2019 vom 29.7.2019
AkdÄ Drug Safety Mail Nr. 41/2019 vom 15.7.2019
- Loperamid: Brugada-Syndrom im Zusammenhang mit Missbrauch
- Propylthiouracil: Risiko angeborener Anomalien
- Rivaroxaban: Vorzeitige Beendigung der GALILEO-Studie bei Patienten nach TAVI
- Secukinumab: Generalisierte exfoliative Dermatitis
- Sulfasalazin: Beeinflussung von Labortests mit NADH/NADP
- Temozolomid: Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS)
- Topiramat: Uveitis
- Clopidogrel, Clopidogrel/ASS: Wechselwirkungen mit einer geboosterten antiviralen Therapie des humanen Immundefizienzvirus (HIV), die zu einer unzureichenden Hemmung der Thrombozytenaggregation führen
- Pantoprazol: Mikroskopische Kolitis
- Serotonin- und Noradrenalin-Wiederaufnahmehemmer (SNRI); selektive Serotonin- Wiederaufnahmehemmer (SSRI): Persistierende sexuelle Funktionsstörung nach Absetzen von Arzneimitteln
Quelle
AkdÄ Drug Safety Mail Nr. 43/2019 vom 29.7.2019
AkdÄ Drug Safety Mail Nr. 41/2019 vom 15.7.2019
Labels:
Clopidogrel,
Clopidogrel/ASS,
Loperamid,
Pantoprazol,
Propylthiouracil,
Rivaroxaban,
Secukinumab,
SNRI,
SSRI,
Sulfasalazin,
Temozolomid,
Topiramat
Freitag, 26. Juli 2019
Atezolizumab, Ceftolozan/Tazobactam, Eculizumab, Elotuzumab, Pembrolizumab, Ranibizumab, Trifluridin/Tipiracil, Ustekinumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juli 2019 empfohlen, die Zulassung von Atezolizumab, Ceftolozan/Tazobactam, Eculizumab, Elotuzumab, Pembrolizumab, Ranibizumab, Trifluridin/Tipiracil und Ustekinumab zu erweitern.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
- Atezolizumab (Tecentriq, Roche) soll künftig bei zwei weiteren Indikationen eingesetzt werden können:
- in Kombination mit nab-Paclitaxel und Carboplatin zur Erstlinientherapie Erwachsener mit metastasiertem NSCLCL mit Nicht-Plattenepithelhistologie ohne EGFR- oder ALK-Mutation.
- in Kombination mit Carboplatin und Etoposid für die Erstlinienbehandlung von Erwachsenen mit kleinzelligem Lungenkarzinom im extensiven Stadium - Ceftolozan/Tazobactam (Zerbaxa, MSD) soll künftig zur Behandlung der nosokomial erworbenen Pneumonie inklusive der Beatmungs-assoziierten Pneumonie eingesetzt werden können.
- Eculizumab (Soliris, Alexion) soll künftig bei Anti-Aquaporin-4-positiven Patienten mit Neuromyelitis-optica-Spektrum-Erkrankungen eingesetzt werden können, bei denen die Erkrankung mit Rezidiven verläuft
- Elotuzumab (Empliciti, BMS) soll künftig in Kombination mit Pomalidomid und Dexamethason bei Erwachsenen mit rezidiviertem oder refraktärem multiplen Myelom eingesetzt werden können, die mindestens zwei vorherige Therapien inklusive Lenalidomid und einem Proteasominhibitor erhalten haben und deren Erkrankung nach der letzten Therapie fortgeschritten ist.
- Pembrolizumab (Keytruda, MSD) soll künftig in Kombination mit Axitinib für die Erstlinientherapie des fortgeschrittenen Nierenzellkarzinoms eingesetzt werden können.
- Ranibizumab (Lucentis, Novartis) soll künftig bei zur Behandlung der Frühgeborenen-Retinopathie eingesetzt werden können.
- Trifluridin/Tipiracil (Lonsurf, Servier) soll künftig als Monotherapie beim metastasiertem Kolorektalkarzinom und als Monotherapie beim metastasierten Magenkarzinom einschließlich des Adenokarzinoms der gastroösophagealen Junktion bei Erwachsenen eingesetzt werden, die zuvor mindestens zwei systemische Therapien erhalten haben.
- Ustekinumab (Stelara, Janssen) soll künftig zur Behandlung von Erwachsenen mit mäßig schwerer bis schwerer Colitis ulcerosa eingesetzt werden können, die nicht ausreichend oder nicht mehr auf konventionelle Therapien und Biologika ansprechen, diese nicht vertragen oder Kontraindikationen aufweisen.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Labels:
Atezolizumab,
Ceftolozan/Tazobactam,
Eculizumab,
Elotuzumab,
Pembrolizumab,
Ranibizumab,
Trifluridin/Tipiracil,
Ustekinumab
Larotrectinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juli 2019 empfohlen, Larotrectinib (Vitrakvi, Bayer AG) für die orale Behandlung von Erwachsenen und Kindern mit soliden Tumoren zuzulassen, die eine NTRK-Genfusion (neurotrophe Tyrosin-Rezeptor-Kinase) aufweisen und deren Tumoren lokal fortgeschrittenen oder metastasiert sind oder die chirurgisch nicht entfernt werden können und für deren Behandlung keine zufriedenstellenden Therapieoptionen zur Verfügung stehen. Larotrectinib wäre das erste Medikament in der EU mit einer tumorunabhängigen Indikation.
TRK-Fusionstumoren sind insgesamt selten, sie können überall im Körper vorkommen, weil die zugrundeliegenden NTRK-Genfusionen unabhängig von bestimmten Zell- oder Gewebearten auftreten können. In klinischen Studien wurde Larotrectinib in 29 verschiedenen Histologien untersucht.
Larotrectinib ist ein hoch-selektiver TRK-Inhibitor, der die durch die NTRK-Genfusion anomalen und kontinuierlich aktiven TRK-Fusionsproteine hemmt. In Studien zeigte der Wirkstoff Wirksamkeit bei Patienten mit TRK-Fusionstumoren unabhängig von Tumortyp und Alter, auch bei Patienten mit Hirnmetastasen oder primären ZNS-Tumoren.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
TRK-Fusionstumoren sind insgesamt selten, sie können überall im Körper vorkommen, weil die zugrundeliegenden NTRK-Genfusionen unabhängig von bestimmten Zell- oder Gewebearten auftreten können. In klinischen Studien wurde Larotrectinib in 29 verschiedenen Histologien untersucht.
Larotrectinib ist ein hoch-selektiver TRK-Inhibitor, der die durch die NTRK-Genfusion anomalen und kontinuierlich aktiven TRK-Fusionsproteine hemmt. In Studien zeigte der Wirkstoff Wirksamkeit bei Patienten mit TRK-Fusionstumoren unabhängig von Tumortyp und Alter, auch bei Patienten mit Hirnmetastasen oder primären ZNS-Tumoren.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Ibalizumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juli 2019 empfohlen, Ibalizumab (Trogarzo, Theratechnologies International Ltd.) in Kombination mit anderen antiretroviralen Substanzen zur parenteralen Behandlung von Erwachsenen mit multiresistenter HIV-Infektion zuzulassen, für die kein anderes antivirales Regime verfügbar ist.
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Cannabidiol von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juli 2019 empfohlen, Cannibidiol (Epidyolex, GW Pharma) für die orale Behandlung von Krämpfen assoziiert mit einem Lennox-Gastaut-Syndrom (LGS) oder einem Dravet-Syndrom (DS) zusammen mit Clobazam bei Patienten ab einem Alter von zwei Jahren zuzulassen.
Cannabidiol verringert die Hyperaktivität von Neuronen über verschiedene Mechanismen, wobei der exakte Wirkungsmechanismus nicht bekannt ist.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Cannabidiol verringert die Hyperaktivität von Neuronen über verschiedene Mechanismen, wobei der exakte Wirkungsmechanismus nicht bekannt ist.
Quelle:
Mitteilung der EMA vom 25. Juli 2019
Donnerstag, 18. Juli 2019
Relebactam in Kombination mit Imipenem/Cilastatin von der FDA zugelassen
Die amerikanische Food and Drug Administration (FDA) hat am 17. Juli 2019 den neuen Beta-Lactamase-Inhibitor Relebactam in Kombination mit Imipenem/Cilastatin (Recarbrio, MSD) für die parenterale Behandlung von erwachsenen Patienten mit komplizierten Harnwegsinfektionen und komplizierten intraabdominalen Infektionen zugelassen. Relebactam ist ein Inhibitor von Beta-Laktamasen der Klassen A und C.
Quelle
Pressemitteilung der FDA vom17. Juli 2019
Quelle
Pressemitteilung der FDA vom17. Juli 2019
Pentosanpolysulfat-Natrium: Rote-Hand-Brief wegen pigmentärer Makulopathie
In einem Rote-Hand-Brief informiert der Hersteller von Pentosanpolysulfat-Natrium (elmiron, bene) über das Risiko einer pigmentären Makulopathie.
Unter Anwendung von Pentosanpolysulfat-Natrium wurden seltene Fälle von pigmentärer Makulopathie berichtet, die vor allem nach Langzeitanwendung aufgetreten sind. Es handelt sich um eine spezifische Form der Makulopathie, die bisher nur im Zusammenhang mit Pentosanpolysulfat-Natrium beobachtet wurde. Es ist nicht bekannt, ob das Absetzen des Medikamentes den Verlauf dieser Netzhauterkrankung stoppt oder verändert.
Zur Früherkennung einer pigmentären Makulopathie sollten die Patienten während der Behandlung mit Pentosanpolysulfat-Natrium regelmäßig augenärztlich untersucht werden. Patienten sollten unverzüglich einen Arzt aufsuchen, wenn sie Veränderungen des Sehens bemerken wie Leseschwierigkeiten und langsame Adaption an schlechte oder reduzierte Lichtverhältnisse.
Elmiron® ist zugelassen zur Behandlung von durch Glomerulationen oder Hunner-Läsionen charakterisierten chronischen Blasenschmerzen bei Erwachsenen mit mittelstarken bis starken Schmerzen sowie Harndrang und Miktionshäufigkeit.
Quelle
AkdÄ Drug Safety Mail Nr. 42-2019 vom 18. 7. 2019
Unter Anwendung von Pentosanpolysulfat-Natrium wurden seltene Fälle von pigmentärer Makulopathie berichtet, die vor allem nach Langzeitanwendung aufgetreten sind. Es handelt sich um eine spezifische Form der Makulopathie, die bisher nur im Zusammenhang mit Pentosanpolysulfat-Natrium beobachtet wurde. Es ist nicht bekannt, ob das Absetzen des Medikamentes den Verlauf dieser Netzhauterkrankung stoppt oder verändert.
Zur Früherkennung einer pigmentären Makulopathie sollten die Patienten während der Behandlung mit Pentosanpolysulfat-Natrium regelmäßig augenärztlich untersucht werden. Patienten sollten unverzüglich einen Arzt aufsuchen, wenn sie Veränderungen des Sehens bemerken wie Leseschwierigkeiten und langsame Adaption an schlechte oder reduzierte Lichtverhältnisse.
Elmiron® ist zugelassen zur Behandlung von durch Glomerulationen oder Hunner-Läsionen charakterisierten chronischen Blasenschmerzen bei Erwachsenen mit mittelstarken bis starken Schmerzen sowie Harndrang und Miktionshäufigkeit.
Quelle
AkdÄ Drug Safety Mail Nr. 42-2019 vom 18. 7. 2019
Montag, 15. Juli 2019
Selinexor von der FDA zugelassen
Die amerikanische Food and Drug Administration (FDA) hat am 3. Juli 2019 Selinexor (XPovio, Karyopharm) beschleunigt und als Orphan Drug für die orale Behandlung von erwachsenen Patienten mit rezidiviertem refraktärem multiplem Myelom in Kombination mit Dexamethason zugelassen, die mindestens vier Vortherapien erhalten haben und deren Erkrankung resistent auf verschiedene Behandlungsformen einschließlich mindestens zwei Proteasominhibitoren und einem CD38-Antikörper ist.
Selinexor ist ein selektiver Inhibitor nukleärer Exportproteine (SINE) wie XP01. Die Wirksamkeit wurde in einer Studie mit 83 Patienten mit RRMM in Kombination mit Dexamethason untersucht. Die Gesamtansprechrate lag bei 25,3%.
Quelle
Pressemitteilung der FDA vom 3. Juli 2019
Selinexor ist ein selektiver Inhibitor nukleärer Exportproteine (SINE) wie XP01. Die Wirksamkeit wurde in einer Studie mit 83 Patienten mit RRMM in Kombination mit Dexamethason untersucht. Die Gesamtansprechrate lag bei 25,3%.
Quelle
Pressemitteilung der FDA vom 3. Juli 2019
Freitag, 12. Juli 2019
Ravulizumab von der EU-Kommission zugelassen
Die EU-Kommission hat am 2. Juli 2019 Ravulizumab (Ultomiris, Alexion) als parenterale Behandlung für Patienten mit paroxysmaler nokturnaler Hämoglobinurie (PNH) zugelassen, bei denen eine Hämolyse zusammen mit einem oder mehreren klinischen Symptomen auf eine hohe Krankheitsaktivität hinweist, oder bei Patienten, die klinisch stabil sind, nachdem sie mindestens während der vergangenen 6 Monate mit Eculizumab behandelt worden sind.
Ravulizumab ist ein monoklonaler Antikörper, der spezifisch an Komplementprotein C5 bindet und dessen Spaltung in C5a (das proinflammatorische Anaphylatoxin) und C5b (die initiierende Untereinheit des terminalen Komplementkomplexes [C5b-9]) hemmt und die Bildung des C5b-9 verhindert. Ravulizumab erhält die frühen Komponenten der Komplementaktivierung, die von wesentlicher Bedeutung für die Opsonisierung von Mikroorganismen und die Elimination (Clearance) von Immunkomplexen sind.
Quelle
EPAR der EMA
Ravulizumab ist ein monoklonaler Antikörper, der spezifisch an Komplementprotein C5 bindet und dessen Spaltung in C5a (das proinflammatorische Anaphylatoxin) und C5b (die initiierende Untereinheit des terminalen Komplementkomplexes [C5b-9]) hemmt und die Bildung des C5b-9 verhindert. Ravulizumab erhält die frühen Komponenten der Komplementaktivierung, die von wesentlicher Bedeutung für die Opsonisierung von Mikroorganismen und die Elimination (Clearance) von Immunkomplexen sind.
Quelle
EPAR der EMA
Dienstag, 9. Juli 2019
Dolutegravir/Lamivudin von der EU-Kommission zugelassen
Die EU-Kommission hat am 1. Juli 2019 die Kombination aus Dolutegravir und Lamivudin (Dovato, ViiV) für die orale Behandlung von Infektionen mit dem humanen Immundefizienz-Virus Typ 1 (HIV-1) bei Erwachsenen und Jugendlichen ab einem Alter von 12 Jahren mit einem Körpergewicht von mindestens 40 kg zugelassen, die keine bekannten oder vermuteten Resistenzen gegenüber der Klasse der Integrase-Inhibitoren oder Lamivudin aufweisen.
Der Integrasehemmer Dolutegravir und der reverse-Transkriptase-Hemmer Lamivudin sind nun als fixe Kombination verfügbar.
Quelle
EPAR der EMA
Der Integrasehemmer Dolutegravir und der reverse-Transkriptase-Hemmer Lamivudin sind nun als fixe Kombination verfügbar.
Quelle
EPAR der EMA
Cemiplimab von der EU-Kommission zugelassen
Die EU-Kommission hat am 28. Juni 2019 Cemiplimab (Libtayo, Regeneron) für die parenterale Monotherapie von Erwachsenen mit metastasiertem oder lokal fortgeschrittenem kutanen Plattenepithelkarzinom bedingt zugelassen, die für eine kurative Operation oder kurative Strahlentherapie nicht in Betracht kommen.
Cemiplimab ist ein monoklonaler Antikörper, der an den PD1-Rezeptor bindet und die Wechselwirkung zwischen PD1-Rezeptor und PD-L1 und PD-L2 hemmt. Cemiplimab verstärkt so die T-ZellAntwort einschließlich der Anti-Tumor-Antwort.
Quelle
EPAR der EMA
Cemiplimab ist ein monoklonaler Antikörper, der an den PD1-Rezeptor bindet und die Wechselwirkung zwischen PD1-Rezeptor und PD-L1 und PD-L2 hemmt. Cemiplimab verstärkt so die T-ZellAntwort einschließlich der Anti-Tumor-Antwort.
Quelle
EPAR der EMA
Freitag, 28. Juni 2019
Atezolizumab, Ceftarolin Fosamil, Dupilumab, Ibrutinib, Immunglobulin, Liraglutid, Insulin aspart, Ramucirumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juni 2019 empfohlen, die Zulassung von Atezolizumab, Ceftarolin Fosamil, Dupilumab, Ibrutinib, Immunglobulin, Liraglutid, Insulin aspart und Ramucirumab zu erweitern.
Quelle:
Mitteilung der EMA vom 28.Juni 2019
- Atezolizumab (Tecentriq,Roche) soll künftig in Kombination mit nab-Paclitaxel (Abraxane) zur Behandlung von Patienten mit nicht resezierbarem lokal fortgeschrittenem oder metastasiertem dreifach negativem Mammakarzinom eingesetzt werden können, wenn der Tumor eine PD-L1-Expression ≥ 1 % aufweist und wenn die Patienten zuvor keine Chemotherapie erhalten haben.
- Ceftarolin Fosamil (Zinforo, Pfizer) soll künftig bei allen Altersstufen - auch bei Neugeborenen - eingesetzt werden können.
- Dupilumab (Duxipent, Sanofi Aventis) soll künftig bei Patienten ab einem Alter von 12 Jahren eingesetzt werden können.
- Ibrutinib (Imbruvica, Janssen) soll künftig auch in Kombination mit Obinutuzumab bei bislang unbehandelter CLL und in Kombination mit Rituximab bei Patienten mit Morbus Waldenström eingesetzt werden können.
- Immunglobulin, human (Flebogamma DIF, Grifols) soll künftig bei sekundären Immundefizienzen eingesetzt werden können bei Patienten, die an schweren oder rezidivierenden Infektionen leiden, bei denen eine antimikrobielle Therapie unwirksam ist und die einen nachgewiesenen Antikörpermangel oder einen Serum-IgG-Spiegel unter 4g/l aufweisen.
- Liraglutid (Victoza, Novo Nordisk) soll künftig bei Patienten ab einem Alter von 10 Jahren eingesetzt werden können
- Insulin aspart (Fiasp, Novo Nordisk) soll künftig bei Patienten ab einem Alter von 1 Jahr eingesetzt werden können.
- Ramucirumab (Cyramza, Lilly) soll künftig in Monotherapie zur Behandlung von Erwachsenen mit fortgeschrittenem oder nicht resektablen hepatozellulären Karzinom eingesetzt werden können, die einen Serum-Alpha-Fetoprotein-Spiegel von ≥ 400 ng/ml aufweisen und mit Sorafenib vorbehandelt worden sind.
Quelle:
Mitteilung der EMA vom 28.Juni 2019
Angiotensin II von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Juni 2019 empfohlen, Angiotensin II (Giapreza, La Jolla) zur parenteralen Behandlung einer refraktären Hypotonie bei Erwachsenen mit septischem oder anderem Schockgeschehen zuzulassen, die trotz adäquater Volumensubstitution, Applikation von Catecholaminen und anderen Vasopressoren hypoton bleiben.
Angiotensin II ist ein aus acht Aminosäuren bestehendes Gewebshormon, dass eine Schlüsselstellung in der Regulation des Blutdrucks einnimmt.
Quelle:
Mitteilung der EMA vom 27. Juni 2019
Angiotensin II ist ein aus acht Aminosäuren bestehendes Gewebshormon, dass eine Schlüsselstellung in der Regulation des Blutdrucks einnimmt.
Quelle:
Mitteilung der EMA vom 27. Juni 2019
Donnerstag, 27. Juni 2019
Febuxostat: Rote-Hand-Brief wegen erhöhter kardiovaskulärer und Gesamtsterblichkeit
In einem Rote-Hand-Brief informieren die Zulassungsinhaber von Febuxostat-haltigen Arzneimitteln über ein erhöhtes Risiko für kardiovaskulär bedingte und Gesamtsterblichkeit bei mit Febuxostat behandelten Patienten in der CARES-Studie.
In der doppelblinden, randomisierten Phase-IV-Studie CARES wurde die kardiovaskuläre Sicherheit von Febuxostat und Allopurinol bei Patienten mit Gicht und schweren kardiovaskulären Komorbiditäten untersucht. Der primäre MACE-Endpunkt (major adverse cardiac event) trat mit vergleichbarer Häufigkeit auf. Allerdings waren unter Febuxostat die kardiovaskuläre Letalität (4,3 vs. 3,2 %; HR 1,34; 95 % Konfidenzintervall [CI] 1,03–1,73) und die Gesamtmortalität (7,8 vs. 6,4 %; HR 1,22; 95 % CI 1,01–1,47) signifikant höher als bei Allopurinol. Die Ergebnisse einer weiteren Phase-IV-Studie (FAST) werden bis zum zweiten Quartal 2020 erwartet.
In der doppelblinden, randomisierten Phase-IV-Studie CARES wurde die kardiovaskuläre Sicherheit von Febuxostat und Allopurinol bei Patienten mit Gicht und schweren kardiovaskulären Komorbiditäten untersucht. Der primäre MACE-Endpunkt (major adverse cardiac event) trat mit vergleichbarer Häufigkeit auf. Allerdings waren unter Febuxostat die kardiovaskuläre Letalität (4,3 vs. 3,2 %; HR 1,34; 95 % Konfidenzintervall [CI] 1,03–1,73) und die Gesamtmortalität (7,8 vs. 6,4 %; HR 1,22; 95 % CI 1,01–1,47) signifikant höher als bei Allopurinol. Die Ergebnisse einer weiteren Phase-IV-Studie (FAST) werden bis zum zweiten Quartal 2020 erwartet.
Bei Patienten mit bestehender schwerer kardiovaskulärer Erkrankung (z. B. Myokardinfarkt, Schlaganfall oder instabile Angina Pectoris) sollte die Behandlung mit Febuxostat vermieden werden, es sei denn, es bestehen keine anderen Therapiemöglichkeiten.
Die Produktinformationen werden aktualisiert.
Quelle:
Dienstag, 25. Juni 2019
Tocilizumab: Rote-Hand-Brief wegen Leberschäden
Die Firma Roche informiert mit einem Rote-Hand-Brief über das Risiko von schweren arzneimittelinduzierten Leberschäden bei der Behandlung mit Tocilizumab (Roactemra).
Eine kumulative Bewertung von Berichten zu aufgetretenen Leberschäden bei mit Tocilizumab behandelten Patienten zeigt, dass diese in seltenen Fällen schwerwiegend sein können. Die Schädigungen umfassten Hepatitis, Gelbsucht und akutes Leberversagen, welches in einigen Fällen eine Lebertransplantation erforderlich machte.
Folgende Maßnahmen werden daher empfohlen:
Die Empfehlungen der Fachinformation zu Dosisanpassungen (Reduktion, Unterbrechung oder Absetzen) aufgrund von Leberwertveränderungen bleiben unverändert.
Quelle
Arzneimittelkommission der Deutschen Apotheker
Eine kumulative Bewertung von Berichten zu aufgetretenen Leberschäden bei mit Tocilizumab behandelten Patienten zeigt, dass diese in seltenen Fällen schwerwiegend sein können. Die Schädigungen umfassten Hepatitis, Gelbsucht und akutes Leberversagen, welches in einigen Fällen eine Lebertransplantation erforderlich machte.
Folgende Maßnahmen werden daher empfohlen:
- Patienten, die Anzeichen einer Leberschädigung zeigen, sollten sofort an einen Arzt verwiesen werden.
- Die Alaninaminotransferase (ALT) und Aspartataminotransferase (AST) sollten bei Patienten mit rheumatologischen Indikationen in den ersten sechs Monaten der Behandlung alle vier bis acht Wochen und anschließend alle zwölf Wochen kontrolliert werden.
- Sollten die ALT oder die AST bei Behandlungsbeginn oberhalb des 1,5-fachen Normwertes liegen, ist besondere Vorsicht geboten.
Die Empfehlungen der Fachinformation zu Dosisanpassungen (Reduktion, Unterbrechung oder Absetzen) aufgrund von Leberwertveränderungen bleiben unverändert.
Quelle
Arzneimittelkommission der Deutschen Apotheker
Talazoparib von der EU-Kommission zugelassen
Die EU-Kommission hat am 20. Juni 2019 Talazoparib (Talzenna, Pfizer) für die orale Behandlung von Frauen mit Keimbahn-BRCA1/2-Mutation und HER2-negativem lokal fortgeschrittenem oder metastasiertem Mammakarzinom zugelassen. Die Frauen sollten mit einem Anthracyclin oder Taxan im (neo)adjuvanten, lokal fortgeschrittenen oder metastasierten Setting behandelt worden sein, es sei denn, sie waren für diese Behandlungen nicht geeignet. Patienten mit Hormonrezeptor (HR)-positivem Brustkrebs sollten außerdem bereits eine endokrin-basierte Therapie erhalten haben oder für diese als nicht geeignet eingestuft sein.
Talazoparib ist ein hochpotenter dual wirkender Inhibitor, der PARP-Enzyme (Poly-ADP-Ribose-Polymerase) hemmt und durch die Hemmung von PARP auch bei Einstrang-DNA-Brüchen die Reparatur von DNA-Schäden hemmt. So verhindern PARP-Inhibitoren, dass Tumorzellen einen durch Zytostatika induzierten DNA-Schaden reparieren.
Talazoparib ist ein hochpotenter dual wirkender Inhibitor, der PARP-Enzyme (Poly-ADP-Ribose-Polymerase) hemmt und durch die Hemmung von PARP auch bei Einstrang-DNA-Brüchen die Reparatur von DNA-Schäden hemmt. So verhindern PARP-Inhibitoren, dass Tumorzellen einen durch Zytostatika induzierten DNA-Schaden reparieren.
Wirksamkeit und Verträglichkeit von Talazoparib wurden in er Phase-III-Studie EMBRACA nachgewiesen.
Quelle
Turoctocog alfa pegol von der EU-Kommission zugelassen
Die EU-Kommission hat amt 20. Juni 2019 Turoctocog alfa pegol (Esperoct, Novonordisk) für die Prophylaxe und Therapie von Blutungen bei Patienten ab einem Alter von 12 Jahren mit Hämophilie A zugelassen.
Turoctocog alfa pegol ist die pegylierte From von Turoctocog alfa (Novo Eight, Novonordisk), einem rekombinant hergestellter humaner Faktor VIII, der die vorübergehende Substitution von endogenem Faktor VIII bei Patienten mit Hämophilie A ermöglicht.
Das PEG ist an das O-gebundene Glykan in der verkürzten B-Domäne von rFVIII (Turoctocog alfa) gebunden.Der Wirkungsmechanismus von Turoctocog alfa pegol basiert darauf, den mangelnden oder fehlenden Faktor VIII bei Patienten mit Hämophilie A zu ersetzen.
Quelle
EPAR der EMA
Turoctocog alfa pegol ist die pegylierte From von Turoctocog alfa (Novo Eight, Novonordisk), einem rekombinant hergestellter humaner Faktor VIII, der die vorübergehende Substitution von endogenem Faktor VIII bei Patienten mit Hämophilie A ermöglicht.
Das PEG ist an das O-gebundene Glykan in der verkürzten B-Domäne von rFVIII (Turoctocog alfa) gebunden.Der Wirkungsmechanismus von Turoctocog alfa pegol basiert darauf, den mangelnden oder fehlenden Faktor VIII bei Patienten mit Hämophilie A zu ersetzen.
Quelle
EPAR der EMA
Avatrombopag von der EU-Kommission zugelassen
Die EU-Kommission hat am 20. Juni 2019 Avatrombopag (Doptelet, Dova) zur oralen Behandlung der schweren Thrombozytopenie bei Erwachsenen mit chronischer Lebererkrankung und geplanten invasiven Maßnahmen zugelassen.
Avatrombopag ist ein oral wirksamer kleinmolekularer Thrombopoetin(TPO)-Rezeptoragonist, der die Proliferation und Differenzierung von Megakaryozyten aus Knochenmark-Progenitorzellen stimuliert, was zu vermehrter Thrombozytenbildung führt. Avatrombopag konkurriert nicht mit TPO um die Bindung an den TPO-Rezeptor und hat mit TPO einen additiven Effekt auf die Thrombozytenbildung.
Die Wirksamkeit und Sicherheit von Avatrombopag zur Behandlung von erwachsenen Patienten mit
chronischer Lebererkrankung und Thrombozytenwerten von ˂ 50 x 109/l, die sich einem Eingriff unterziehen müssen, wurde in zwei identisch aufgebauten, multizentrischen, randomisierten,
doppelblinden, placebokontrollierten Phase-III-Studien untersucht (Studie 1 und Studie 2).
Quelle:
EPAR der EMA
Avatrombopag ist ein oral wirksamer kleinmolekularer Thrombopoetin(TPO)-Rezeptoragonist, der die Proliferation und Differenzierung von Megakaryozyten aus Knochenmark-Progenitorzellen stimuliert, was zu vermehrter Thrombozytenbildung führt. Avatrombopag konkurriert nicht mit TPO um die Bindung an den TPO-Rezeptor und hat mit TPO einen additiven Effekt auf die Thrombozytenbildung.
Die Wirksamkeit und Sicherheit von Avatrombopag zur Behandlung von erwachsenen Patienten mit
chronischer Lebererkrankung und Thrombozytenwerten von ˂ 50 x 109/l, die sich einem Eingriff unterziehen müssen, wurde in zwei identisch aufgebauten, multizentrischen, randomisierten,
doppelblinden, placebokontrollierten Phase-III-Studien untersucht (Studie 1 und Studie 2).
Quelle:
EPAR der EMA
Montag, 24. Juni 2019
Bremelanotid von der FDA zugelassen
Die Food and Drug Administration (FDA) hat am 21. Juni 2019 Bremelanotid (Vyleesi, AMAG Pharmaceuticals) zur parenteralen Behandlung einer hypoaktiven Sexualfunktionsstörung (Hypoactive Sexual Desire Disorder, HSDD) bei prämenopausalen Frauen zugelassen.
Bremelanotid ist ein synthetisches, zyklisches Peptidanalogon des α-Melanozyten-stimulierenden Hormons (α-MSH). Es besteht aus7 Aminosäuren (Heptapeptid) und ist ein aktiver Metabolit von Melanotan-II. Bremelanotid aktiviert Melanocortin-Rezeptoren, allerdings ist noch nicht bekannt, wie es die sexuelle Funktion verbessert.
Es wird etwa 45 Minuten vor der sexuellen Aktivität subkutan injiziert, innerhalb von 24 Stunden sollte nicht mehr als eine Dosis injiziert werden. Pro Monat sollten maximal 8 Dosen appliziert werden.
Die Therapie sollte nach acht Wochen abgebrochen werden, wenn sich keine Besserung der Beschwerden einstellt.
Die FDA hatte für diese Indikation im August 2015 bereits Flibanserin zugelassen (siehe med|pharm|text-Blog).
Quelle
Pembrolizumab: FDA erweitert Zulassung auf SCLC
Die Food and Drug Administration (FDA) hat die Zulassung von Pembrolizumab (Keytruda, MSD) erweitert. Es kann nun auch zur Behandlung von Patienten mit metastasiertem kleinzelligem Lungenkarzinom (SCLC) eingesetzt, deren Erkrankung während oder nach einer Platin-basierten Chemotherapie und mindestens einer weiteren Vortherapie fortgeschritten ist.
Die Wirksamkeit von Pembrolizumab beim SCLC war bei 83 Patienten mit Progression während oder nach mindestens zwei Vortherapien in Kohorte G der Keynote-158- und in Kohorte C1 der Keynote-028-Studie untersucht worden. Mit Pembrolizumab wurde eine Ansprechrate von 19 % erreicht, 2 % der Patienten sprachen kompett an. Bei 94 % der Patienten hielt das Ansprechen mindesstens 6 Monate, bei 63 % 12 Monate und bei 56 % 18 Monate an.
Quelle
Mitteilung der FDA vom 17. Juni 2019
Die Wirksamkeit von Pembrolizumab beim SCLC war bei 83 Patienten mit Progression während oder nach mindestens zwei Vortherapien in Kohorte G der Keynote-158- und in Kohorte C1 der Keynote-028-Studie untersucht worden. Mit Pembrolizumab wurde eine Ansprechrate von 19 % erreicht, 2 % der Patienten sprachen kompett an. Bei 94 % der Patienten hielt das Ansprechen mindesstens 6 Monate, bei 63 % 12 Monate und bei 56 % 18 Monate an.
Quelle
Mitteilung der FDA vom 17. Juni 2019
Freitag, 21. Juni 2019
Olaparib: EU-Kommission erweitert Zulassung
Die EU-Kommission hat am 12. Juni 2019 die Zulassung von Olaparib zu erweitert: Der PARP-Hemmer kann künftig als Erhaltungstherapie nach einer Primärtherapie beim BRCA-mutierten fortgeschrittenen Ovarialkarzinom eingesetzt werden können. Die Empfehlung gilt für die Erhaltungstherapie von erwachsenen Patientinnen mit einem fortgeschrittenen (FIGO Stadium III und IV) BRCA 1/2-mutierten (Keimbahn und/oder somatisch) high-grade epithelialen Ovarial-, Eileiter- oder Peritonealkarzinom nach Ansprechen auf eine Erstlinientherapie mit einer Platin-basierten Chemotherapie.
Quelle:
EPAR der EMA
Quelle:
EPAR der EMA
Montag, 17. Juni 2019
Daratumumab: Rote-Hand-Brief wegen Reaktivierung von Hepatitis B
In einem Rote-Hand-Brief informiert der Hersteller (Janssen-Cilag) von Daratumumab (Darzalex) zu einem erhöhten Risiko der Reaktivierung einer Hepatitis B, und zwar liegen Berichte aus klinischen Studien sowie Spontanmeldungen über eine Reaktivierung von Hepatits-B-Virus vor. Einige Fälle verliefen tödlich.
Die meisten Fälle von HBV-Reaktivierung wurden in den ersten sechs Monaten der Behandlung beobachtet. Mögliche Risikofaktoren sind: frühere autologe Stammzelltransplantation; gleichzeitige und/oder frühere immunsuppressive Therapien; Patienten, die in Regionen mit hoher HBV-Prävalenz leben oder aus diesen eingewandert sind. Die Produktinformation wird aktualisiert.
Quelle:
AkdÄ Drug Safety Mail Nr. 34 vom 17. Juni 2019
- Vor Beginn der Behandlung mit Daratumumab soll bei allen Patienten der HBV-Status bestimmt werden. Dies gilt auch unter laufender Behandlung, wenn der HBV-Status nicht bekannt ist.
- Bei positiver HBV-Serologie sollen Patienten während der Behandlung sowie mindestens sechs Monate nach Beendigung auf klinische Anzeichen und Laborparameter für eine HBV-Reaktivierung kontrolliert werden.
- Im Falle einer HBV-Reaktivierung soll die Behandlung mit Daratumumab unterbrochen und Experten für die Behandlung der HBV-Infektion konsultiert werden.
Die meisten Fälle von HBV-Reaktivierung wurden in den ersten sechs Monaten der Behandlung beobachtet. Mögliche Risikofaktoren sind: frühere autologe Stammzelltransplantation; gleichzeitige und/oder frühere immunsuppressive Therapien; Patienten, die in Regionen mit hoher HBV-Prävalenz leben oder aus diesen eingewandert sind. Die Produktinformation wird aktualisiert.
Quelle:
AkdÄ Drug Safety Mail Nr. 34 vom 17. Juni 2019
Dienstag, 11. Juni 2019
Polatuzumab Vedotin von der FDA beschleunigt zugelassen
Die Food and Drug Administration (FDA) hat am 10. Juni 2019 beschleunigt Polatuzumab vedotin piiq (Polivy, Roche) in Kombination mit Bendamustin und Rituximab für die Behandlung von Erwachsenen mit diffusem großen B-Zell-Lymphom (DLBCL) zugelassen, die mit mindestens zwei Vortherapien behandelt wordensind.
Polatuzumab Vedotin ist ein Antikörper-Arzneistoff-Konjugat, das spezifisch an das CD79b-Protein auf der Oberfläche von B-Zellen bindet und dann das Zytostatikum Monomethylauristatin E (Vedotin) in die Zellen freisetzt. Vedotin verhindert die Polymerisation von Tubulin.
Quelle:
Pressemitteilung der FDA vom 10. Juni 2019
Polatuzumab Vedotin ist ein Antikörper-Arzneistoff-Konjugat, das spezifisch an das CD79b-Protein auf der Oberfläche von B-Zellen bindet und dann das Zytostatikum Monomethylauristatin E (Vedotin) in die Zellen freisetzt. Vedotin verhindert die Polymerisation von Tubulin.
Quelle:
Pressemitteilung der FDA vom 10. Juni 2019
Donnerstag, 6. Juni 2019
Betibeglogen autotemcel als Gentherapie für transfusionsabhängige Beta-Thalassämie (TDT) von der EU-Kommission bedingt zugelassen
Die EU-Kommission hat am 4. Juni 2019 eine bedingte Marktzulassung für Betibeglogen autotemcel (Zynteglo) (autologe CD34+-Zellen, die das Beta A-T87Q-Globin-Gen kodieren) erteilt. Dabei handelt es sich um eine Gentherapie für Patienten ab einem Alter von 12 Jahren mit transfusionsabhängiger Beta-Thalassämie (TDT) und einem Nicht-Beta0/Beta0-Genotyp, für die eine hämatopoetische Stammzellen-Transplantation (HSZT) in Frage kommt, aber kein verwandter Spender mit passendem humanen Leukozytenantigen (HLA) verfügbar ist.
Quelle:
EPAR der EMA
Quelle:
EPAR der EMA
Freitag, 31. Mai 2019
Arginin/Lysin von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Mai 2019 empfohlen, Arginin/Lysin (LysaKare, Advanced Accelerator Applications) zur Verminderung der Strahlenbelastung der Nieren bei Radionuklid-Therapie mit Lutetium (177Lu) Oxodotreotid bei Erwachsenen zuzulassen.
Die Infusionslösung enthält die Aminosäuren L-Arginin-HCl und L-Lysin-HCl, die die Re-Absorption und Retention von Lutetium (177Lu) oxodotreotid in den Nierentubuli vermindern.
Quelle:
Mitteilung der EMA vom 29. Mai 2019
Die Infusionslösung enthält die Aminosäuren L-Arginin-HCl und L-Lysin-HCl, die die Re-Absorption und Retention von Lutetium (177Lu) oxodotreotid in den Nierentubuli vermindern.
Quelle:
Mitteilung der EMA vom 29. Mai 2019
Trientindihydrochlorid von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Mai 2019 empfohlen, Trientindihydrochlorid (Cufence, Univar BV) für die orale Behandlung der Wilson-Krankheit bei Jugendlichen, Erwachsenen und Kindern ab einem Alter von 5 Jahren zuzulassen, die D-Penicillamin nicht vertragen.
Trientindihydrochlorid entzieht dem Körper Kupfer, in dem es einen einen stabilen Kupfer-Chelat-Komplex bildet, der mit dem Urin ausgeschieden wird. Außerdem kann es die Kupfer-Absorption im Gastrointestinaltrakt hemmen.
Bereits im September 2017 hatte die EMA Trientintetrahydrochlorid (Cuprior, gmp-orphan) für die gleiche Indikation zugelassen (med|pharm|text)
Quelle:
Mitteilung der EMA vom 29. Mai 2019
Trientindihydrochlorid entzieht dem Körper Kupfer, in dem es einen einen stabilen Kupfer-Chelat-Komplex bildet, der mit dem Urin ausgeschieden wird. Außerdem kann es die Kupfer-Absorption im Gastrointestinaltrakt hemmen.
Bereits im September 2017 hatte die EMA Trientintetrahydrochlorid (Cuprior, gmp-orphan) für die gleiche Indikation zugelassen (med|pharm|text)
Quelle:
Mitteilung der EMA vom 29. Mai 2019
Dienstag, 28. Mai 2019
Tofacitinib: Rote-Hand-Brief wegen Risiko von Lungenembolien
Der Hersteller von Tofacitinib (Xeljanz, Pfizer) weist in einem Rote-Hand-Brief auf die Einschränkung der Anwendung von zweimal täglich 10 mg bei Patienten mit erhöhtem Risiko für Lungenembolien hin.
Vorläufige Ergebnisse aus einer laufenden klinischen Studie bei Patienten mit rheumatoider Arthritis (A3921133) zeigten ein erhöhtes Risiko für das Auftreten von Lungenembolien und eine erhöhte Sterblichkeit unter der Gabe von zweimal täglich 10 mg Tofacitinib. Die Europäische Arzneimittel-Agentur (EMA) bewertet deshalb zurzeit Nutzen und Risiken von Tofacitinib in allen zugelassenen Indikationen. Bis zum Abschluss der Bewertung wurden folgende Maßnahmen vereinbart:
Tofacitinib ist zugelassen zur Behandlung der rheumatoiden Arthritis und der Psoriasis-Arthritis (jeweils 5 mg zweimal täglich) sowie zur Behandlung von Colitis ulcerosa (10 mg zweimal täglich in den ersten acht Wochen, anschließend 5 mg zweimal täglich).
Die weitere Bewertung der Studiendaten und der möglichen Auswirkung auf die Produktinformation erfolgt derzeit durch die EMA.
Quelle:
AkDÄ Drug Safety Mail Nr. 32 vom 28. 5. 2019
Vorläufige Ergebnisse aus einer laufenden klinischen Studie bei Patienten mit rheumatoider Arthritis (A3921133) zeigten ein erhöhtes Risiko für das Auftreten von Lungenembolien und eine erhöhte Sterblichkeit unter der Gabe von zweimal täglich 10 mg Tofacitinib. Die Europäische Arzneimittel-Agentur (EMA) bewertet deshalb zurzeit Nutzen und Risiken von Tofacitinib in allen zugelassenen Indikationen. Bis zum Abschluss der Bewertung wurden folgende Maßnahmen vereinbart:
- Tofacitinib zweimal täglich 10 mg ist kontraindiziert bei Patienten mit erhöhtem Risiko für Lungenembolien (Patienten mit Herzinsuffizienz, tiefer Venenthrombose oder Lungenembolie in der Vorgeschichte, erblicher Gerinnungsstörung oder Krebs, bei Anwendung kombinierter hormoneller Kontrazeptiva oder einer Hormonersatztherapie sowie bei Patienten, die sich einem größeren chirurgischen Eingriff unterziehen). Weitere Risikofaktoren wie Lebensalter, Adipositas, Nikotinkonsum und Immobilisation sollen bei der Bewertung des Lungenembolie-Risikos in Betracht gezogen werden.
- Ärzte werden daran erinnert, bei Patienten mit rheumatoider Arthritis oder Psoriasis-Arthritis die zugelassene Dosis von 5 mg zweimal täglich einzuhalten.
- Patienten mit erhöhtem Risiko für Lungenembolien, die bereits mit Tofacitinib zweimal täglich 10 mg behandelt werden, sollen auf eine alternative Therapie umgestellt werden.
- Patienten sollen auf Zeichen und Symptome einer Lungenembolie überwacht und angewiesen werden, bei Auftreten von Symptomen sofort einen Arzt zu konsultieren.
Tofacitinib ist zugelassen zur Behandlung der rheumatoiden Arthritis und der Psoriasis-Arthritis (jeweils 5 mg zweimal täglich) sowie zur Behandlung von Colitis ulcerosa (10 mg zweimal täglich in den ersten acht Wochen, anschließend 5 mg zweimal täglich).
Die weitere Bewertung der Studiendaten und der möglichen Auswirkung auf die Produktinformation erfolgt derzeit durch die EMA.
Quelle:
AkDÄ Drug Safety Mail Nr. 32 vom 28. 5. 2019
Samstag, 25. Mai 2019
Alpelisib von der FDA zugelassen
Die FDA hat am 24. Mai 2019 Alpelisib (Piqray, Novartis) zur oralen Behandlung von postmenopausalen Frauen und Männern mit Hormonrezeptor-positivem, Her2-negativem PIK3-CA-mutierten fortgeschrittenem oder metastasiertem Mammakarzinom in Kombination mit Fulvestrant zugelassen.
Parallel wurde ein diagnostischer Test zum Nachweis der PIK3CA-Mutation in Gewebe oder Flüssigkeiten (liquid biopsy) zugelassen.
Wirksamkeit und Verträglichkeit wurden in den SOLAR-1-Studie an 572 Frauen untersucht. Die zusätzliche Gabe von Albelisib zu Fulvestrant verlängerte bei Patienten mit PIK3CA-Mutation das PFS von 5,7 auf 11 Monate.
Quelle:
Pressemitteilung der FDA vom 24.5.2019
Parallel wurde ein diagnostischer Test zum Nachweis der PIK3CA-Mutation in Gewebe oder Flüssigkeiten (liquid biopsy) zugelassen.
Wirksamkeit und Verträglichkeit wurden in den SOLAR-1-Studie an 572 Frauen untersucht. Die zusätzliche Gabe von Albelisib zu Fulvestrant verlängerte bei Patienten mit PIK3CA-Mutation das PFS von 5,7 auf 11 Monate.
Quelle:
Pressemitteilung der FDA vom 24.5.2019
Abonnieren
Posts (Atom)