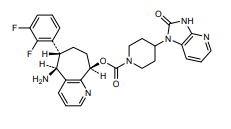
Die EU-Kommission hat am 29. April 2022 Daridorexant (Quviviq, Idorsia) zur Behandlung von Erwachsenen mit Schlafstörungen (Insomnie) zugelassen, deren Symptome seit mindestens 3 Monaten anhalten und eine beträchtliche Auswirkung auf die Tagesaktivität haben.
Daridorexant ist ein dualer Orexin-Rezeptor-Antagonist, der mit gleicher Potenz auf Orexin-1- und Orexin-2-Rezeptoren wirkt. Die Orexin-Neuropeptide (Orexin A und Orexin B) wirken auf die Orexin-Rezeptoren und fördern die Wachheit.Daridorexant antagonisiert die Aktivierung der Orexin-Rezeptoren durch die Orexin-Neuropeptide, verringert somit die Wachheit und erleichtert das Einschlafen, ohne das Verhältnis der Schlafphasen zu verändern.
Die Wirksamkeit von Daridorexant wurde in zwei multizentrischen, randomisierten, doppelblinden, placebokontrollierten Parallelgruppen-Studien der Phase III, Studie 1 und Studie 2, mit identischem Studiendesign beurteilt.
Quelle