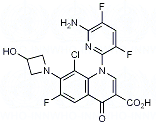
Die EU-Kommission hat am 24. Oktober 2019 Gilteritinib (Xospata, Astellas) als Orphan Drug in Monotherapie für die orale Behandlung von Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML) mit einer FLT3-Mutation zugelassen.
Gilteritinibfumarat ist ein FLT3- und AXL-Inhibitor. Gilteritinib inhibiert die Signalwege des FLT3-Rezeptors und die Proliferation in den Zellen, die FLT3-Mutationen exogen exprimieren, einschließlich FLT3-ITD, FLT3-D835Y und FLT3-ITDD835Y, und es induziert eine Apoptose bei leukämischen Zellen, die FLT3-ITD exprimieren.
Wirksamkeit und Verträglichkeit wurden in der offenen, multizentrischen, randomisierten Phase-3-Studie Admiral untersucht, in der 371 Patienten mit r/r-AMLT und FLT3-Mutation eingeschlossen worden waren. Gilterinib verlängerte im Vergleich zu Chemotherapie das GEsamtüberleben von 5,6 auf 9,3 Monate.
Quelle
EPAR der EMA
Mittwoch, 30. Oktober 2019
Dienstag, 22. Oktober 2019
Daratumumab, Esketamin, Insulin glargin, Ivacaftor, Pembrolizumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, die Zulassung von Daratumumab, Esketamin, Insulin glargin, Ivacaftor, Pembrolizumab zu erweitern.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
- Daratumumab (Darzalex, Janssen) soll künftig auch in Kombination mit Lenalidomid und Dexamethason bei Erwachsenen mit neu diagnostiziertem multiplem Myelom eingesetzt werden können, für die eine Stammzelltransplantation nicht in Frage kommt.
- Esketamin soll als Spravato in Kombination mit einem SSRI oder SNRI zur Behandlung von Erwachsenen mit therapieresistenter Major Depression eingesetzt werden können, die auf mindestens zwei unterschiedliche Antidepressiva bei der aktuellen Depressionsepisode nicht angesprochen haben. Spravato wird als Nasenspray appliziert.
- Insulin glargin (Toujeo, Sanofi Aventis) soll künftig bei Jugendlichen und Kindern ab einem Alter von 6 Jahren eingesetzt werden können.
- Ivacaftor (Kalydeco, Vertex) soll künftig schon bei Kindern ab 6 Monaten und Babies ab 5 kg mit zystischer Fibrose eingesetzt werden können.
- Pembrolizumab (Keytruda, MSD) soll künftig in Monotherapie oder in Kombination mit Platin-haltiger Chemotherapie und 5-Fluorouracil für die Erstlinienbehandlung von metastasierten oder nichtresezierbaren rezidivierten Kopf-Hals-Tumoren mit Plattenepithelhistologie bei Erwachsenen eingesetzt werden können, wenn die Tumoren PD-L1 mit einer CPS ≥ 1 exprimieren.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Romosozumab von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Romosozumab (Evenity, UCB) für die parenterale Behandlung der schweren Osteoporose bei postmenopausalen Frauen mit hohem Frakturrisiko zuzulassen.
Romosozumab ist ein monoklonaler Antikörper, der Sclerostin hemmt. Sclerostin spielt eine wichtige Rolle beim Knochenauf- und -abbau. Durch Hemmung von Sclerostin wird die Knochenneubildung verstärkt und der Knochenabbau gehemmt.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Romosozumab ist ein monoklonaler Antikörper, der Sclerostin hemmt. Sclerostin spielt eine wichtige Rolle beim Knochenauf- und -abbau. Durch Hemmung von Sclerostin wird die Knochenneubildung verstärkt und der Knochenabbau gehemmt.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Upadacitinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Upadacitinib (Rinvoq, Abbvie) für die orale Behandlung der mäßig schweren bis schweren aktiven rheumatoiden Arthritis bei Erwachsenen zuzulassen, die nicht ausreichend auf eines oder mehrere DMARDs ansprechen oder diese nicht vertragen. Upadacitinib kann in Monotherapie oder in Kombination mit Methotrexat eingesetzt werden.
Upadacitinib ist ein selektiver Hemmer der Januskinasen 1 oder 1/3 (JAK).
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Upadacitinib ist ein selektiver Hemmer der Januskinasen 1 oder 1/3 (JAK).
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Delafloxacin von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, Delafloxacin (Quofenix, Menarini) zur parenteralen und oralen Behandlung von akuten bakteriellen Infektionen der Haut und der Weichgewebe bei Erwachsenen zuzulassen, wenn andere allgemein empfohlene Antibiotika nicht eingesetzt werden können.
Delafloxacin ist ein Fluorchinolonderivat, das auch bei schwierig zu behandelnden Erregern wie MRSA und multiresistenten gramnegativen Bakterien wirkt. Bei parenteraler Gabe wirkte Delafloxacin vergleichbar gut wie Vancomycin plus Aztreonam.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Delafloxacin ist ein Fluorchinolonderivat, das auch bei schwierig zu behandelnden Erregern wie MRSA und multiresistenten gramnegativen Bakterien wirkt. Bei parenteraler Gabe wirkte Delafloxacin vergleichbar gut wie Vancomycin plus Aztreonam.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Nasal applizierbares Glucagon von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, nasal applizierbares Glucagon (Baqsimi, Lilly) zur Behandlung der schweren Hypoglykämie zuzulassen. Damit steht erstmals eine nicht injizierbare Glucagonzubereitung zur Verfügung.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Ebolaimpfstoff von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom Oktober 2019 empfohlen, erstmals bedingt einen Impfstoff gegen Ebola, die Ebola Zaire Vakzine rVSVΔG-ZEBOV-GP, live (Ervebo) zuzulassen.
Der Impfstoff soll für die aktive Immunisierung von Personen ab 18 Jahren eingesetzt werden, die ein Risiko für eine Infektion mit dem Ebola-Virus haben. Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Der Impfstoff soll für die aktive Immunisierung von Personen ab 18 Jahren eingesetzt werden, die ein Risiko für eine Infektion mit dem Ebola-Virus haben. Es handelt sich um eine gentechnisch hergestellte, attenuierte Lebendvakzine, die bei etwa 16.000 Personen in verschiedenen klinischen Studien in Afrika, Europa und den USA getestet worden ist. Dabei erwies sie sich als sicher und ausreichend immunogen, um einen Schutz gegen das Zaira Ebola Virus zu vermitteln.
Quelle:
Mitteilung der EMA vom 18. Oktober 2019
Dienstag, 8. Oktober 2019
Avelumab, Belimumab, Docetaxel, Dupilumab, Ranibizumab: EMA empfiehlt Zulassungserweiterung
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, die Zulassung von Avelumab, Belimumab, Docetaxel, Dupilumab, Ranibizumab zu erweitern.
Quelle:
Mitteilung der EMA vom 20. September 2019
- Avelumab (Bavencio, Merck) soll in Kombination mit Axitinib in der Erstlinientherapie von Erwachsenen mit fortgeschrittenem Nierenzellkarzinom eingesetzt werden können.
- Belimumab (Benlysta, GSK) soll künftig bei Kindern ab einem Alter von 5 Jahren eingesetzt werden können.
- Docetaxel (z. B. Taxotere, Sanofi) soll in Kombination mit ADT mit oder ohne Prednison bzw. Prednisolon bei Patienten mit metastasiertem hormonsensiblen Prostatakarzinom eingesetzt werden können.
- Dupilumab (Dupixent, Sanofi) soll als Add-on-Therapie zu nasalen Glucocorticoiden bei Erwachsenen mit schwerer chronischer Rhinosinusitis mit nasaler Polyposis eingesetz werden können, bei denen systemische Glucocorticoide oder/und eine Operatoin keine adäquate Krankheitskontrolle ermöglichen.
- Ranibizumab (Lucentis, Novartis) soll für die Behandlung der proliferativen diabetischen Retinopathie eingesetzt werden können.
Quelle:
Mitteilung der EMA vom 20. September 2019
Gilteritinib von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, Gilteritinib (Xospata, Astellas)in Monotherapie für die orale Behandlung von Patienten mit rezidivierter oder refraktärer akuter myeloischer Leukämie (AML) mit einer FLT3-Mutation zuzulassen.
Gilteritinib ist ein Proteinkinase-Inhibitor, der das FLT3-Rezeptor-Signalling hemmt und nachfolgend in leukämischen Zellen, die FLT3-ITD exprimieren zur Apoptose führt.
Quelle:
Mitteilung der EMA vom 20. September 2019
Gilteritinib ist ein Proteinkinase-Inhibitor, der das FLT3-Rezeptor-Signalling hemmt und nachfolgend in leukämischen Zellen, die FLT3-ITD exprimieren zur Apoptose führt.
Quelle:
Mitteilung der EMA vom 20. September 2019
Netarsudil von der EMA zur Zulassung empfohlen
Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Zulassungsbehörde (EMA) hat in seiner Sitzung vom September 2019 empfohlen, Netarsudil (Rhokiinsa, Aerie Pharmaceuticals) als Augentropfen für die Behandlung von Patienten mit Glaukom oder okularer Hypertension zuzulassen.
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle:
Mitteilung der EMA vom 20. September 2019
Netasurdil ist eine Rho-Kinaseinhibitor, der den intraokularen Druck dadurch reduziert, dass der Abfluss von Kammerwasser über das trabekuläre Netzwerk verstärkt wird.
Netasurdil hat in den zulassungsrelevanten Studien (ROCKET 1 und ROCKET 2) den Augeninnendruck um bis zu 5 mm Hg gesenkt. Die Wirkung war bei einem Ausgangsinnendruck von unter 25 mm Hg mit der von Timolol-Augentropfen vergleichbar.
Quelle:
Mitteilung der EMA vom 20. September 2019
Ibalizumab von der EU-Kommission zugelassen
Die EU-Kommission hat am 26. September 2019 Ibalizumab (Trogarzo, Theratechnologies International Ltd.) in Kombination mit anderen antiretroviralen Substanzen zur parenteralen Behandlung von Erwachsenen mit multiresistenter HIV-Infektion zugelassen, für die kein anderes antivirales Regime verfügbar ist.
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle
EPAR der EMA
Ibalizumab bindet selektiv an die Domäne 2 (D2) des CD4-T-Zellrezeptors. Dies hat eine Konformationsänderung des Rezeptor-gp120-Komplexes zur Folge. Dadurch wird die Fusion und das Eindringen des HI-Virus verhindert. Ibalizumab gehört damit ebenso wie der Fusionsinhibitor Enfuvirtid (Fuzeon®) und der CCR5-Antagonist Maraviroc (Celsentri®) zur Klasse der Entry-Inhibitoren.
Quelle
EPAR der EMA
Abonnieren
Posts (Atom)