Die Food and Drug Administration (FDA) hat Peramivir (Rapivab, BioCryst Pharmaceuticals) für die Behandlung der Influenza bei Erwachsenen zugelassen.
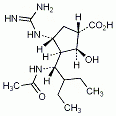
Peramivir ist wie Oseltamivir (Tamiflu) und Zanamivir (Relenza) ein Neuraminidase-Hemmer, der jedoch einmalig intravenös appliziert wird. Er kann bei Patienten ab 18 Jahren mit akuter unkomplizierter Influenza eingesetzt werden, deren Symptome noch nicht länger als zwei Tage anhalten.
Die Wirksamkeit wurde in einer randomisierten Studie mit Influenza-Patienten untersucht, die Plazebo oder 300 mg oder 600 mg Peramivir erhielten. Mit 600 mg Peramivir besserten sich die Influenza-Symptome im Mittel 21 Stunden früher als in der Plazebo-Gruppe. Die Körpertemperatur normalisierte sich im Mittel um 12 Stunden früher. Diese Befunde konnten in weiteren Studie bestätigt werden.
Bei Patienten mit schwerer Influenza, die eine Hospitalisierung erfordert, war Peramivir nicht wirksam.
Häufige Nebenwirkungen waren Durchfall, Selten aber schwerwiegend waren schwere Hautreaktionen wie Stevens-Johnson-Syndrom oder Erythema multiforme. Halluzinationen, Delirium oder ungewöhnliches Verhalten unter der Therapie mit Neuraminidase-Hemmern können durch die Influenza selbst hervorgerufen werden. Unklar ist, inwieweit Neuraminidase-Hemmer als auslösende Faktoren eine Rolle spielen.
Quelle:
Pressemitteilung der FDA vom 22. Dezember 2014
Abonnieren
Kommentare zum Post (Atom)




Keine Kommentare:
Kommentar veröffentlichen